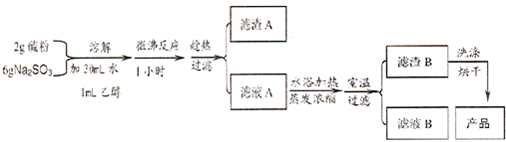
题目内容
A为烃的含氧衍生物,相对分子质量为88,其分子中C、H、O三种元素的质量比为6:l:4.
(1)A的分子式为 .
(2)已知:RCH2OH+HBr?RCH2Br+H2O
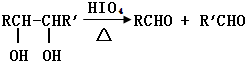
A有如下转关系,其中A不能使Br2的CCl4溶液褪色;B转化为C时,n(B):n(C)=1:2.
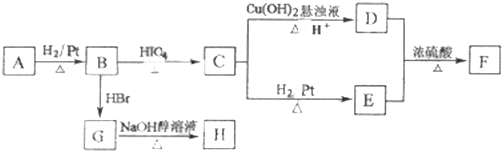
①A→B的反应类型为 C→D的反应类型为
②A的结构简式为 F的结构简式为
③H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为
④W是A的一种同分异构体,其碳原子上的氢被氯取代后的一氯代物只有两种,l mol W可在HIO4加热的条件下反应,产物只有l mol Q,则w的结构简式为 .
(1)A的分子式为
(2)已知:RCH2OH+HBr?RCH2Br+H2O
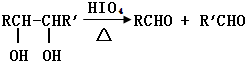
A有如下转关系,其中A不能使Br2的CCl4溶液褪色;B转化为C时,n(B):n(C)=1:2.

①A→B的反应类型为
②A的结构简式为
③H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为
④W是A的一种同分异构体,其碳原子上的氢被氯取代后的一氯代物只有两种,l mol W可在HIO4加热的条件下反应,产物只有l mol Q,则w的结构简式为
考点:有机物的推断
专题:有机物的化学性质及推断
分析:(1)A为烃的含氧衍生物,其分子中C、H、O三种元素的质量比为6:l:4,则N(C):N(H):N(O)=
:
:
=2:4:1,最简式为C2H4O,令A的组成为(C2H4O)n,相对分子质量为88,则44n=88,故n=2,则A的分子式为C4H8O2;
(2)A不能使Br2的CCl4溶液褪色,与氢气发生加成反应生成B,B转化为C时,n(B):n(C)=1:2,结合反应信息可知,B为对称结构,故A为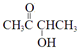 ,B为
,B为 ,C为CH3CHO,D为CH3COOH,E为CH3CH2OH,F为CH3COOCH2CH3.B与HBr发生取代反应生成G为
,C为CH3CHO,D为CH3COOH,E为CH3CH2OH,F为CH3COOCH2CH3.B与HBr发生取代反应生成G为 ,G发生消去反应生成H,H分子中所有碳原子均在一条直线上,则H为CH3C≡CCH3,据此解答.
,G发生消去反应生成H,H分子中所有碳原子均在一条直线上,则H为CH3C≡CCH3,据此解答.
| 6 |
| 12 |
| 1 |
| 1 |
| 4 |
| 16 |
(2)A不能使Br2的CCl4溶液褪色,与氢气发生加成反应生成B,B转化为C时,n(B):n(C)=1:2,结合反应信息可知,B为对称结构,故A为
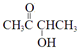 ,B为
,B为 ,C为CH3CHO,D为CH3COOH,E为CH3CH2OH,F为CH3COOCH2CH3.B与HBr发生取代反应生成G为
,C为CH3CHO,D为CH3COOH,E为CH3CH2OH,F为CH3COOCH2CH3.B与HBr发生取代反应生成G为 ,G发生消去反应生成H,H分子中所有碳原子均在一条直线上,则H为CH3C≡CCH3,据此解答.
,G发生消去反应生成H,H分子中所有碳原子均在一条直线上,则H为CH3C≡CCH3,据此解答.解答:
解:(1)A为烃的含氧衍生物,其分子中C、H、O三种元素的质量比为6:l:4,则N(C):N(H):N(O)=
:
:
=2:4:1,最简式为C2H4O,令A的组成为(C2H4O)n,相对分子质量为88,则44n=88,故n=2,则A的分子式为C4H8O2,故答案为:C4H8O2;
(2)A不能使Br2的CCl4溶液褪色,与氢气发生加成反应生成B,B转化为C时,n(B):n(C)=1:2,结合反应信息可知,B为对称结构,故A为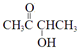 ,B为
,B为 ,C为CH3CHO,D为CH3COOH,E为CH3CH2OH,F为CH3COOCH2CH3.B与HBr发生取代反应生成G为
,C为CH3CHO,D为CH3COOH,E为CH3CH2OH,F为CH3COOCH2CH3.B与HBr发生取代反应生成G为 ,G发生消去反应生成H,H分子中所有碳原子均在一条直线上,则H为CH3C≡CCH3,
,G发生消去反应生成H,H分子中所有碳原子均在一条直线上,则H为CH3C≡CCH3,
①A→B是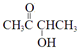 与氢气发生加成反应生成
与氢气发生加成反应生成 ;C→D是CH3CHO发生氧化反应生成CH3COOH,故答案为:加成反应;氧化反应;
;C→D是CH3CHO发生氧化反应生成CH3COOH,故答案为:加成反应;氧化反应;
②由上述分析可知,A的结构简式为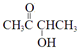 ,F的结构简式为CH3COOCH2CH3,故答案为:
,F的结构简式为CH3COOCH2CH3,故答案为: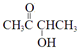 ;CH3COOCH2CH3;
;CH3COOCH2CH3;
③G转化为H的化学方程式为: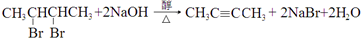 ,
,
故答案为: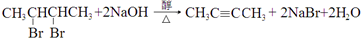 ;
;
④W是A(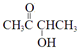 )的一种同分异构体,其碳原子上的氢被氯取代后的一氯代物只有两种,l mol W可在HIO4加热的条件下反应,产物只有l mol Q,应存在碳原子形成的四元环,且2个羟基处于相邻碳原子上,则w的结构简式为
)的一种同分异构体,其碳原子上的氢被氯取代后的一氯代物只有两种,l mol W可在HIO4加热的条件下反应,产物只有l mol Q,应存在碳原子形成的四元环,且2个羟基处于相邻碳原子上,则w的结构简式为  ,故答案为:
,故答案为: .
.
| 6 |
| 12 |
| 1 |
| 1 |
| 4 |
| 16 |
(2)A不能使Br2的CCl4溶液褪色,与氢气发生加成反应生成B,B转化为C时,n(B):n(C)=1:2,结合反应信息可知,B为对称结构,故A为
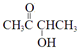 ,B为
,B为 ,C为CH3CHO,D为CH3COOH,E为CH3CH2OH,F为CH3COOCH2CH3.B与HBr发生取代反应生成G为
,C为CH3CHO,D为CH3COOH,E为CH3CH2OH,F为CH3COOCH2CH3.B与HBr发生取代反应生成G为 ,G发生消去反应生成H,H分子中所有碳原子均在一条直线上,则H为CH3C≡CCH3,
,G发生消去反应生成H,H分子中所有碳原子均在一条直线上,则H为CH3C≡CCH3,①A→B是
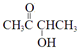 与氢气发生加成反应生成
与氢气发生加成反应生成 ;C→D是CH3CHO发生氧化反应生成CH3COOH,故答案为:加成反应;氧化反应;
;C→D是CH3CHO发生氧化反应生成CH3COOH,故答案为:加成反应;氧化反应;②由上述分析可知,A的结构简式为
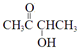 ,F的结构简式为CH3COOCH2CH3,故答案为:
,F的结构简式为CH3COOCH2CH3,故答案为: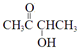 ;CH3COOCH2CH3;
;CH3COOCH2CH3;③G转化为H的化学方程式为:
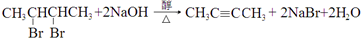 ,
,故答案为:
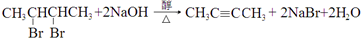 ;
;④W是A(
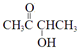 )的一种同分异构体,其碳原子上的氢被氯取代后的一氯代物只有两种,l mol W可在HIO4加热的条件下反应,产物只有l mol Q,应存在碳原子形成的四元环,且2个羟基处于相邻碳原子上,则w的结构简式为
)的一种同分异构体,其碳原子上的氢被氯取代后的一氯代物只有两种,l mol W可在HIO4加热的条件下反应,产物只有l mol Q,应存在碳原子形成的四元环,且2个羟基处于相邻碳原子上,则w的结构简式为  ,故答案为:
,故答案为: .
.
点评:本题考查有机物推断,需要学生对给予的信息进行利用,注意根据A的性质及B生成C的反应特点推断,结合的考查学生自学能力与分析推理能力,难度中等.

练习册系列答案
相关题目
已知Xn-、Yn+、Z三种微粒具有相同的核外电子层结构,下列分析中正确的是( )
| A、离子半径大小关系是Xn-<Yn+ |
| B、Z一定是稀有气体元素的原子 |
| C、原子序数关系是Z>Y>X |
| D、原子半径关系是Y<X |
把20g氢氧化钠溶于水,配成500mL溶液,此溶液的物质的量浓度为( )
| A、2 mol?L-1 |
| B、1 mol?L-1 |
| C、0.5 mol?L-1 |
| D、1.5mol?L-1 |
下列关于氧化物的叙述不正确的是( )
①非金属氧化物不一定属于酸性氧化物
②酸性氧化物都属于非金属氧化物
③金属氧化物都属于碱性氧化物
④碱性氧化物都属于金属氧化物
⑤酸性氧化物都能与水反应生成相应的含氧酸
⑥两性氧化物既能与酸也能与碱反应生成盐和水
⑦不能与酸反应的氧化物一定能与碱反应
⑧与水反应生成含氧酸的氧化物一定是酸性氧化物.
①非金属氧化物不一定属于酸性氧化物
②酸性氧化物都属于非金属氧化物
③金属氧化物都属于碱性氧化物
④碱性氧化物都属于金属氧化物
⑤酸性氧化物都能与水反应生成相应的含氧酸
⑥两性氧化物既能与酸也能与碱反应生成盐和水
⑦不能与酸反应的氧化物一定能与碱反应
⑧与水反应生成含氧酸的氧化物一定是酸性氧化物.
| A、①②③⑥⑧ |
| B、②③⑤⑦⑧ |
| C、②③⑤⑥⑦ |
| D、②③④⑥⑧ |
常温下单质硫主要以S8形式存在.加热时,S8会转化为S6、S4、S2等.当温度达到750℃时,硫蒸气主要以S2形式存在(占92%).下列说法中正确的是( )
| A、S8转化为S6、S4、S2属于物理变化 |
| B、不论哪种硫分子,完全燃烧时都生成SO2 |
| C、S8、S6、S4、S2均属于共价化合物 |
| D、把硫单质在空气中加热到750℃即得S2 |
关于离子浓度的关系,下列说法错误的是( )
| A、浓度均为0.1 mol/L的NH4Cl溶液和氨水等体积混合后:c(NH4+)+c(NH3?H2O)=2c(Cl- ) |
| B、新制氯水中:c(Cl- )>c(H+ )>c(OH- )>c(ClO- ) |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(CH3COO-)>c(Na+)>c(H+ )>c(OH- ) |
| D、常温下,pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+ )>c(Cl- )>c(OH- )>c(H+ ) |
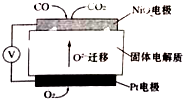 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)