题目内容
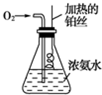 按如图所示的装置进行实验:
按如图所示的装置进行实验:实验开始一段时间后,可观察到锥形瓶瓶口上方有白烟生成,请补充可能观察到的其他现象:
考点:实验装置综合,氨的化学性质
专题:实验题
分析:催化作用下,氨气和氧气发生氧化还原反应生成NO和水,反应为放热反应,生成的NO可与氧气、水反应生成硝酸,硝酸与氨气反应生成硝酸铵,可观察到白烟生成,以此解答该题.
解答:
解:氨气和氧气在铂丝作催化剂条件下加热发生4NH3+5O2
4NO+6H2O;反应为放热反应,可观察到铂丝保持红热,继续发生2NO+O2═2NO2,瓶中有红棕色气体生成,二氧化氮和水反应生成硝酸,发生3NO2+H2O═2HNO3+NO,进而发生NH3+HNO3═NH4NO3,可观察到有白烟生成.
故答案为:瓶中有红棕色气体生成;铂丝保持红热;4NH3+5O2
4NO+6H2O;2NO+O2═2NO2;3NO2+H2O═2HNO3+NO;NH3+HNO3═NH4NO3.
| ||
故答案为:瓶中有红棕色气体生成;铂丝保持红热;4NH3+5O2
| ||
点评:本题以氨气的性质为载体,综合考查性质实验,为高频考点,注意把握氨气的性质以及相关反应,答题时注意相关反应的方程式的书写,难度不大.

练习册系列答案
相关题目
关于离子浓度的关系,下列说法错误的是( )
| A、浓度均为0.1 mol/L的NH4Cl溶液和氨水等体积混合后:c(NH4+)+c(NH3?H2O)=2c(Cl- ) |
| B、新制氯水中:c(Cl- )>c(H+ )>c(OH- )>c(ClO- ) |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(CH3COO-)>c(Na+)>c(H+ )>c(OH- ) |
| D、常温下,pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+ )>c(Cl- )>c(OH- )>c(H+ ) |
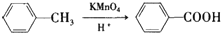
 (苯胺,易被氧化)
(苯胺,易被氧化)