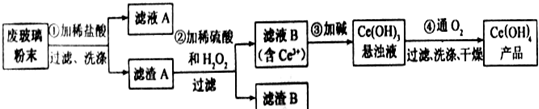
题目内容
20.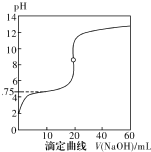 25℃时,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如右图所示.下列说法正确的是( )
25℃时,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如右图所示.下列说法正确的是( )| A. | 当滴人40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| B. | 当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+) | |
| C. | 当滴人NaOH溶液20mL时c(OH-)>c(H+)+c(HA) | |
| D. | 当滴定到pH=4.75时,c(A-)=c(HA) |
分析 A.当滴人40mLNaOH溶液时,溶液中溶质为等浓度的NaOH和NaA,A-发生水解,浓度减小;
B.当溶液中c(H+)+c(OH-)=2×10-7时溶液呈中性;
C.根据质子守恒分析;
D.当滴定到pH=4.75时,根据Ka=$\frac{c({A}^{-})×c({H}^{+})}{c(HA)}$计算.
解答 解:A.用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1一元酸HA,当滴人40mLNaOH溶液时,溶液中溶质为等浓度的NaOH和NaA,A-发生水解,浓度减小,所以c(OH-)>c(A-),所以溶液中:c(Na+)>c(OH-)>c(A-)>c(H+),故A错误;
B.当溶液中c(H+)+c(OH-)=2×10-7时,溶液呈中性,c(Na+)=c(A-)>c(OH-)=c(H+),故B错误;
C.当滴人NaOH溶液20mL时,二者恰好反应生成NaA,溶液中存在质子守恒为c(OH-)=c(H+)+c(HA),故C错误;
D.当滴定到pH=4.75时,c(H+)=10-4.75mol/L,已知Ka=$\frac{c({A}^{-})×c({H}^{+})}{c(HA)}$=10-4.75,则c(A-)=c(HA),故D正确;
故选D.
点评 本题考查了图象分析方法,酸碱中和反应后溶液酸碱性的判断,溶液中电荷守恒和离子浓度大小比较是解题关键,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.25℃、101kPa下:①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ.mol-1
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ.mol-1
下列说法不正确的是( )
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ.mol-1
下列说法不正确的是( )
| A. | ①和②产物的阴阳离子个数比相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数相同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s)△H=-317kJ.mol-1 |
3.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 0.1mol•L-1的NaOH溶液中含Na+数目为0.1NA | |
| B. | 标准状况下,2.24L乙酸中含碳原子数目为0.2NA | |
| C. | 12gC60中含质子总数为6NA | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数目为0.2NA |
12.下列说法正确的是( )
| A. | 向1ml 1mol/L的NaOH的溶液中滴加1~2滴2mol/LMgCl2溶液有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,出现红褐色沉淀,则证明Mg(OH)2的Ksp大于Fe(OH)3 | |
| B. | 由pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后的溶液显酸性 | |
| C. | 由0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后的溶液显酸性 | |
| D. | 某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7,则该溶液的pH一定为14-a |
9.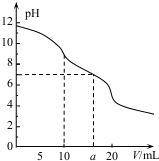 常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
 常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | 当V=0时:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) | |
| B. | 当V=5时:c(Na+ )>c(HCO3-)>c(CO32- )>c(Cl- ) | |
| C. | 当V=a时:c(Na +)>c(Cl- )>c(H+ )=c(OH- ) | |
| D. | 当V=10时:c(H+ )+c(H2CO3)=c(OH- )+c(CO32-) |
10.在室温下,等体积的酸和碱溶液混合后pH一定小于7的是( )
| A. | pH=3的HNO3与pH=11的KOH溶液 | |
| B. | pH=3的HNO3与pH=11的氨水 | |
| C. | pH=3的H2SO4与pH=11的NaOH | |
| D. | pH=3的CH3COOH 与pH=11的Ba(OH)2溶液 |