题目内容
10.在室温下,等体积的酸和碱溶液混合后pH一定小于7的是( )| A. | pH=3的HNO3与pH=11的KOH溶液 | |
| B. | pH=3的HNO3与pH=11的氨水 | |
| C. | pH=3的H2SO4与pH=11的NaOH | |
| D. | pH=3的CH3COOH 与pH=11的Ba(OH)2溶液 |
分析 等体积的酸和碱溶液混合后pH一定小于7,则溶液显酸性,根据酸碱的强弱判断溶液中n(H+)与n(OH-)关系进行判断和计算.
解答 解:A.pH=3的硝酸中c(H+)=1×10-3mol/L,pH=11的氢氧化钾溶液中c(OH-)=1×10-3mol/L,在室温下等体积混合后,pH=7,故A错误;
B.pH=3的硝酸中c(H+)=1×10-3mol/L,pH=11的氨水中c(OH-)=1×10-3mol/L,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7,故B错误;
C.pH=3的H2SO4与pH=11的NaOH,硫酸中c(H+)=1×10-3mol/L,pH=11的氢氧化钠溶液中c(OH-)=1×10-3mol/L,在室温下等体积混合后,pH=7,故C错误;
D、pH=3的醋酸c(H+)=1×10-3mol/L,pH=11的氢氧化钡溶液中c(OH-)=1×10-3mol/L,由于醋酸为弱酸,则醋酸过量,在室温下等体积混合后,pH<7,故D正确.
故选D.
点评 本题考查酸碱混合时的定性判断及有关pH的计算,题目难度不大,注意判断酸碱的强弱并以此判断反应的过量问题.

练习册系列答案
相关题目
20.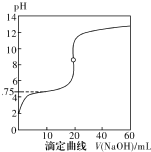 25℃时,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如右图所示.下列说法正确的是( )
25℃时,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如右图所示.下列说法正确的是( )
 25℃时,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如右图所示.下列说法正确的是( )
25℃时,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如右图所示.下列说法正确的是( )| A. | 当滴人40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| B. | 当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+) | |
| C. | 当滴人NaOH溶液20mL时c(OH-)>c(H+)+c(HA) | |
| D. | 当滴定到pH=4.75时,c(A-)=c(HA) |
1.氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时:
①HF(aq)+OH-(aq)?H2O(l)+F(aq)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
在20Ml0.lmol/L的氢氟酸中滴加0.lmol/L的NaOH V mL,下列说法正确的是( )
①HF(aq)+OH-(aq)?H2O(l)+F(aq)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
在20Ml0.lmol/L的氢氟酸中滴加0.lmol/L的NaOH V mL,下列说法正确的是( )
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?H+(aq)+F-(aq)△H=+10.4kJ/mol | |
| B. | 当V=20 mL时,溶液中:c(OH-)=c(HF)+c(H+) | |
| C. | 当V=20 mL时,溶液中:c(F-)=c(Na+)=0.1mol/L | |
| D. | 当v>0时,溶液中一定存在c(Na+)>c(F-)>c(OH-)>c(H+) |
18.在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00mL、浓度均为0.1mol•L-1盐酸和醋酸溶液中分别滴加0.1mol•L-1NaOH溶液.随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:
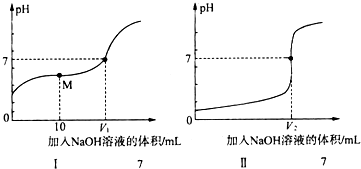
①用NaOH溶液滴定醋酸溶液的曲线是I(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中V1和V2大小的比较:V1<V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)(用离子的物质的量浓度符号填空).
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀、溶液红色变浅(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
(1)向体积均为20.00mL、浓度均为0.1mol•L-1盐酸和醋酸溶液中分别滴加0.1mol•L-1NaOH溶液.随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:

①用NaOH溶液滴定醋酸溶液的曲线是I(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中V1和V2大小的比较:V1<V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)(用离子的物质的量浓度符号填空).
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol•L-1AgNO3溶液中加入20mL0.05mol•L-1KSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中滴加少量2mol•L-1Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol•L-1AgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol•L-1KI溶液中 | 出现黄色沉淀 |
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀、溶液红色变浅(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
2.由于金属锌本身的价值不高,在我国工业锌废料的回收利用率比较低.某课题组研究利用含少量铜、铁的粗锌制备硫酸锌及相关物质的资源综合利用,其工艺流程图(图中加入的物质均为足量)及有关数据如下:
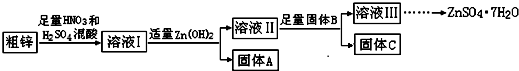
请回答下列问题:
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是将Cu2+(或铜)从溶液Ⅱ中分离出来.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是14.7~14.85g;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=Zn2++H2S↑.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.

| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是将Cu2+(或铜)从溶液Ⅱ中分离出来.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是14.7~14.85g;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=Zn2++H2S↑.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.
19.由短周期元素形成的化合物A2B3,A3+比B2+少一个电子层,且A3+具有与Ne原子相同的核外电子层结构,下列说法正确的是( )
| A. | A2B3是三氧化二铝 | B. | A3+与B2-最外层上的电子数相同 | ||
| C. | A是第2周期第ⅢA族的元素 | D. | B是第3周期第ⅥA族的元素 |
20.在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol/L和1.5mol/L,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是( )
| A. | 反应后溶液中H+剩余 1.8mol | |
| B. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 | |
| C. | 反应后产生13.44L H2(标准状况) | |
| D. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol |
 请按要求回答下列问题.
请按要求回答下列问题. 硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题:
硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题: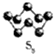 )易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.
)易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.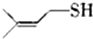 ).
).