题目内容
19.现有Fe、Al、Si三种单质的混合物,取一半投入足量的NaOH溶液中,将剩余的一半投入足量的稀硫酸中,若经测量两次实验产生的气体质量相等,则原混合物中Fe、Al、Si三种单质的物质的量之比可能为( )| A. | 6:4:3 | B. | 1:1:1 | C. | 2:3:4 | D. | 3:7:6 |
分析 铝与氢氧化钠和稀硫酸反应,且生成氢气的量相同;Fe只与稀硫酸反应,Si只与氢氧化钠溶液反应,两次实验产生的气体质量相等,根据电子守恒可知反应中铁与Si失去电子的物质的量相等,据此进行解答.
解答 解:现有Fe、Al、Si三种单质的混合物,取一半投入足量的NaOH溶液中,将剩余的一半投入足量的稀硫酸中,由于Al能够与稀硫酸、NaOH溶液反应,且生成氢气的物质的量相等,则Al的量不影响结果;
若经测量两次实验产生的气体质量相等,则混合物中Fe、Si生成氢气的物质的量相等,根据电子守恒可知:2n(Fe)=4n(Si),即n(Fe):n(Si)=2:1,选项中只有A满足,
故选A.
点评 本题考查了混合物反应的计算,题目难度不大,明确发生反应的原理为解答关键,注意掌握电子守恒在化学计算中的应用,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
10.关于如图所示原电池装置的叙述,正确的是( )
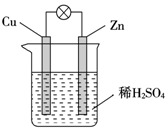

| A. | 电子从铜片经外电路流向锌 | B. | Zn为负极,Cu为正极 | ||
| C. | H+在铜片上得电子发生氧化反应 | D. | 该装置能将电能转化为化学能 |
7.对于反应:N2+3H2?2NH3△H<0,下列叙述正确的是( )
| A. | 升高温度,逆反应速率加快,正反应速率减慢 | |
| B. | 使用催化剂比不使用催化剂化学平衡常数要大 | |
| C. | 由勒夏特列原理可知合成氨时,分离出NH3可以提高原料利用率 | |
| D. | 加压能加快反应速率,因为增加了活化分子百分数 |
14.下列说法正确的是( )
| A. | 自然界中的金属都是以化合态形式存在的 | |
| B. | 金属活动性虽然不同,但冶炼方法是相同的 | |
| C. | 金属矿物资源丰富且可再生,可尽量开采利用 | |
| D. | 金属的冶炼就是把金属化合物还原为金属单质 |
8.下列说法中正确的是( )
| A. | Na2S2O3 (aq)+2HCl(aq)=2NaCl(aq)+S(s)+SO2(g)+H2O(l)在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反 应方向移动 | |
| B. | 若在恒容容器中发生反应:N2(g)+3H2(g)?2NH3 (g),达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率一时间图象可用图一表示 | |
| D. | 若在恒压容器中发生反应:2SO3 (g)?2SO2 (g)+O2 (g),达到平衡后再充人适量He,其速率一时间图象可用图二表示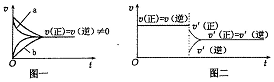 |
13.NaNO2+NH4Cl═NaCl+N2+2H2O.下列关于该反应的说法中,正确的是( )
| A. | NH4Cl中的N元素被还原 | |
| B. | 生成1 mol N2时转移的电子数为6 mol | |
| C. | NaNO2是氧化剂 | |
| D. | N2既是氧化剂又是还原剂 |