题目内容
10.关于如图所示原电池装置的叙述,正确的是( )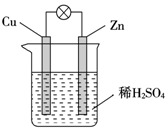
| A. | 电子从铜片经外电路流向锌 | B. | Zn为负极,Cu为正极 | ||
| C. | H+在铜片上得电子发生氧化反应 | D. | 该装置能将电能转化为化学能 |
分析 铜、锌、硫酸原电池中,锌易失电子作负极,发生氧化反应,铜作正极,正极上得电子发生还原反应,电子从负极沿导线流向正极,原电池是将化学能转化为电能的装置,据此回答.
解答 解:A、铜、锌、硫酸原电池中,锌易失电子作负极,铜作正极,电子从负极沿导线流向正极,即从锌片经外电路流向铜,故A错误;
B、铜、锌、硫酸原电池中,锌易失电子作负极,铜作正极,故B正确;
C、H+在铜片上得电子发生还原反应,故C错误;
D、原电池是将化学能转化为电能的装置,故D错误.
故选B.
点评 本题考查了原电池原理,根据原电池概念、得失电子、电子流向来分析解答即可,注意正极上电极反应,难点是电极反应式的书写,题目难度不大.

练习册系列答案
相关题目
20.如果把12C的相对原子质量定义为24,以0.024 kg12C所含的C原子数为阿伏加德罗常数,在标准状况时下列数值肯定不变的是( )
| A. | 浓硫酸(98%)的物质的量浓度 | B. | 常温下氯化钠的溶解度 | ||
| C. | 标准状况下气体摩尔体积 | D. | 0.2g金刚石所含的C原子数 |
1.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| D. | 聚氯乙烯塑料薄膜可用作食品保鲜膜、一次性食品袋等 |
18.NA代表阿伏加德罗常数的值,下列说法错误的是( )
| A. | 2.8g铁与0.05mol Cl2充分反应,转移0.1NA电子 | |
| B. | 27g Al与足量NaOH溶液反应生成 33.6L H2 | |
| C. | 1mol由乙烯(C2H4)和乙烷(C2H6)组成的混合物中含有碳原子的数目为2NA | |
| D. | 0.1mol Na2O2与足量二氧化碳反应转移0.1NA个电子 |
15.氯苯是燃料、医药、有机合成的中间体,是重要的有机化工产品.实验室制取氯苯如图1所示(加热和固定仪器的装置略去).
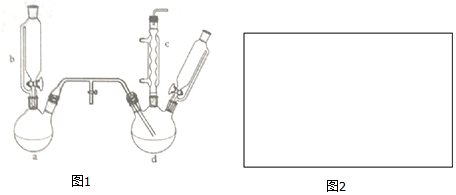
回答下列问题:
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a装置中的固体反应物可以是BC.(填序号)
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d装置有FeCl3和苯),加热维持反应温度40-60℃,温度过高会生成过多的二氯苯.对d加热的方法是水浴加热.
(3)装置c的名称是(球形)冷凝管,装置c出口的气体成分有HCl、Cl2、水蒸气和苯蒸汽.
(4)制取氯苯的化学方程式为: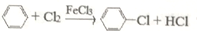 .
.
(5)装置d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.
①碱洗之前要水洗.其目的是洗去FeCl3、HCl等无机物.节省碱的用量,降低成本.
②10%NaOH溶液碱洗时发生氧化还原反应的化学反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O.
(6)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸汽,请在图2中画出,并标明所用试剂.
(7)工业生产中苯的流失情况如表所示:
则10t 苯可制得成品氯苯$\frac{10×(1-0.0892)×112.5}{78}$t.(列出计算式即可.氯苯和苯的相对分子质量分别是112,5和78)

回答下列问题:
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a装置中的固体反应物可以是BC.(填序号)
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d装置有FeCl3和苯),加热维持反应温度40-60℃,温度过高会生成过多的二氯苯.对d加热的方法是水浴加热.
(3)装置c的名称是(球形)冷凝管,装置c出口的气体成分有HCl、Cl2、水蒸气和苯蒸汽.
(4)制取氯苯的化学方程式为:
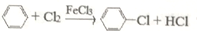 .
.(5)装置d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.
①碱洗之前要水洗.其目的是洗去FeCl3、HCl等无机物.节省碱的用量,降低成本.
②10%NaOH溶液碱洗时发生氧化还原反应的化学反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O.
(6)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸汽,请在图2中画出,并标明所用试剂.
(7)工业生产中苯的流失情况如表所示:
| 项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
| 苯流失量(t/kg) | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
2.下列各溶液中能大量共存的离子组是( )
| A. | 澄清透明的溶液中:Fe2+、Mg2+、SO42-、Cl- | |
| B. | 使酚酞试液呈红色的溶液中:Al3+、Cu2+、SO42-、K+ | |
| C. | 使石蕊试液变红的溶液中:Na+、Cl-、K+、HCO3- | |
| D. | 碳酸钠溶液中:Ba2+、NO3-、Cl-、H+ |
19.现有Fe、Al、Si三种单质的混合物,取一半投入足量的NaOH溶液中,将剩余的一半投入足量的稀硫酸中,若经测量两次实验产生的气体质量相等,则原混合物中Fe、Al、Si三种单质的物质的量之比可能为( )
| A. | 6:4:3 | B. | 1:1:1 | C. | 2:3:4 | D. | 3:7:6 |
4.下列关于气体摩尔体积的叙述中正确的是( )
| A. | 1mol二氧化碳在标准状况时所占的体积约是22.4L | |
| B. | 氧气在标准状况下頕有体积约为22.4L | |
| C. | 1mol任何物质在0℃,1.01×105Pa时体积都约是22.4L | |
| D. | 1mol任何气体的体积都约是22.4L |