题目内容
13.电子表中的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.请回答:放电时氧化银电极上的反应式为:Ag2O+H2O+2e-=2Ag+2OH-;随着电极反应的进行,锌极区域的pH减小填“增大”、“不变”、“减小”);当 6.5g Zn 完全溶解时,电子转移了0.2 mol.
分析 根据电池反应式Ag2O+H2O+Zn═Zn(OH)2+2Ag知,失电子的物质作负极,得电子的物质作正极,原电池放电时,电子从负极沿导线流向正极;根据电池电极附近氢离子或氢氧根离子浓度的变化判断溶液pH值的变化,根据关系式计算电子转移的物质的量.
解答 解:电池反应式Ag2O+H2O+Zn═Zn(OH)2+2Ag中,较活泼的金属锌作负极,失去电子发生氧化反应,氧化银得电子发生还原反应,所以氧化银作正极,正极的反应为Ag2O+H2O+2e-=2Ag+2OH-;原电池放电时,负极上锌失电子和氢氧根离子反应生成氧化锌和水,电极反应为电极反应式为:Zn-2e-+2OH-═Zn(OH)2,所以负极附近氢氧根离子浓度降低,溶液的pH值减小;当有6.5g锌溶解时,转移电子物质的量为$\frac{6.5g}{65g/mol}$×2=0.2mol,
故答案为:Ag2O+H2O+2e-=2Ag+2OH-;减小;0.2.
点评 本题考查了原电池原理,难度不大,明确原电池正负极的判断方法、外电路中电子的流向、电极附近离子浓度的变化导致溶液pH值的变化即可解答本题.

练习册系列答案
相关题目
10.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24L三氯甲烷中含有的共价键数目为0.4NA | |
| B. | 常温常压下,7.8gNa2O2中含有阴离子的数目为0.1NA | |
| C. | 1mol羟基与1mol氢氧根离子所含电子数均为9NA | |
| D. | 在1.0L 0.1mol•L-1Na2CO3溶液中,阴离子总数小于0.1NA |
4.下列各组内的物质,按单质、化合物、混合物的顺序排列正确的是( )
| A. | 固态氨,矿泉水,漂粉精 | B. | 液态氧,干冰,水玻璃 | ||
| C. | 稀有气体,氯化钾,铁矿石 | D. | 天然气,氧化汞,不锈钢 |
8.2016年4月22日是第47个世界地球日.今年地球日主题为“珍惜地球资源,转变发展方式”.下列行为不符合活动主题的是( )
| A. | 实现能源的清洁利用,就需开发新能源 | |
| B. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| C. | 落实资源的“3R”发展观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse) | |
| D. | 更新采煤、采油技术,提高产量以满足工业生产的快速发展 |
18.下列铁的化合物可以分别通过化合反应、置换反应、复分解反应生成的是( )
| A. | FeCl2 | B. | Fe3O4 | C. | Fe(OH)3 | D. | Fe2(SO4)3 |
5.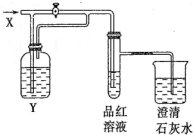 向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.
向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.
X和Y可能是 ( )
 向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.
向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.X和Y可能是 ( )
| 选项 | A | B | C | D |
| X | NO2 | SO2 | HCl | Cl2 |
| Y | 水 | 饱和NaHCO3溶液 | Na2SO3溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
2.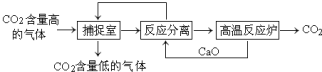 “碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).下列有关该方法的叙述中正确的是( )
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).下列有关该方法的叙述中正确的是( )
 “碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).下列有关该方法的叙述中正确的是( )
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).下列有关该方法的叙述中正确的是( )| A. | 该方法的一大缺点是能耗较大 | |
| B. | 整个过程中,只有一种物质可以循环利用 | |
| C. | 该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品 | |
| D. | “反应分离”环节中,分离物质的基本操作是蒸发、结晶、过滤 |
3.下列有关表述正确的是( )
| A. | N原子的价电子轨道表示式: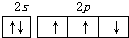 | |
| B. | 碳酸氢钠在水溶液中的电离方程式:NaHCO3?Na++H++CO32- | |
| C. | 羧基的结构式: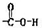 | |
| D. | 明矾的化学式为 KAlSO4•12H2O |