题目内容
15.12.04×1023个SO2分子,在标准状况下的体积是多少?分析 根据n=$\frac{N}{{N}_{A}}$计算出12.04×1023个SO2分子的物质的量,标准状况下气体摩尔体积为22.4L/mol,再根据V=nVm计算出二氧化碳在标准状况下的体积.
解答 解:12.04×1023个SO2分子的物质的量为:n(SO2)=$\frac{12.04×1{0}^{23}}{6.02×1{0}^{12}mo{l}^{-1}}$=2mol,
2molSO2分子在标准状况下的体积为:V(SO2)=22.4L/mol×2mol=44.8L,
答:12.04×1023个SO2分子在标准状况下的体积是44.8L.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、摩尔质量之间的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的 化学计算能力.

练习册系列答案
相关题目
5.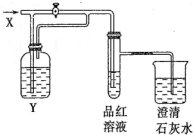 向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.
向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.
X和Y可能是 ( )
 向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.
向如图所示的装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色.X和Y可能是 ( )
| 选项 | A | B | C | D |
| X | NO2 | SO2 | HCl | Cl2 |
| Y | 水 | 饱和NaHCO3溶液 | Na2SO3溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
3.下列有关表述正确的是( )
| A. | N原子的价电子轨道表示式: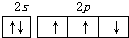 | |
| B. | 碳酸氢钠在水溶液中的电离方程式:NaHCO3?Na++H++CO32- | |
| C. | 羧基的结构式: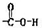 | |
| D. | 明矾的化学式为 KAlSO4•12H2O |
10.下列溶液中微粒浓度关系一定正确的是( )
| A. | pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 | |
| B. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)] | |
| C. | pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 | |
| D. | 0.10 mol•L-1 Na2CO3溶液:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
20.某蓝色手柄滴定管滴定后读数如图所示,则以下记录的数据正确的是( )
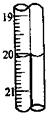

| A. | 20.00mL | B. | 20.0mL | C. | 20.10mL | D. | 20.1mL |
7.如图所示,在101kPa时,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法正确的是( )


| A. | 石墨的燃烧热为393.5kJ/mol | |
| B. | 石墨转变成金刚石需要吸收能量,是物理变化 | |
| C. | 石墨比金刚石稳定 | |
| D. | 1mol金刚石与1molO2的总能量低于1molCO2的总能量 |




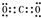 .
.