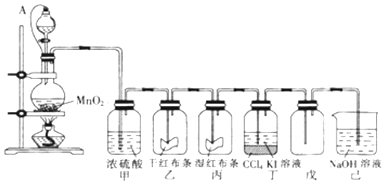
题目内容
6.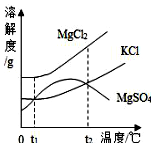 海洋资源开发前景十分广阔.海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,图是它们的溶解度曲线.则下列说法不正确的是( )
海洋资源开发前景十分广阔.海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,图是它们的溶解度曲线.则下列说法不正确的是( )| A. | t1℃时,三种物质的饱和溶液中,溶质质量分数最大的是MgCl2 | |
| B. | t1℃时,分别在100g水中溶解了等质量的MgCl2、KCl,两溶液都可达到饱和 | |
| C. | t2℃时,KCl和MgSO4两种物质的溶解度相同 | |
| D. | 将卤水加热到t2℃以上,析出的晶体主要为MgSO4 |
分析 由MgCl2、KCl、MgSO4的溶解度曲线图可知:各物质的溶解度随温度变化的趋势;KCl和MgSO4的溶解度相等的温度有:t1℃、t2℃;将三物质的饱和溶液的温度从t2℃降至t1℃,有晶体析出等信息,并结合饱和溶液中溶质的质量分数计算式$\frac{溶解度}{100+溶解度}$×100%进行解答.
解答 解:A、在t1℃时,三种物质的溶解度中MgCl2的最大,据饱和溶液中溶质的质量分数计算式可知溶解度越大溶质的质量分数越大,所以饱和溶液中,溶质质量分数最大的是MgCl2,故A正确;
B、t1℃时,分别在100g水中溶解了等质量的MgCl2、KCl,两溶液不一定达到饱和,若加入的两物质质量少,则不饱和,故B错误;
C、由图可知:t2℃时,KCl和MgSO4两种物质的溶解度相等,故C正确;
D、由图可知;三种物质t2℃时的溶解度均大于t1℃时的溶解度,高于t2℃时硫酸镁的溶解度随温度升高而减小,所以将卤水加热到t2℃以上,析出的晶体只有MgSO4,故D正确;
故选B.
点评 本题考查了溶液中溶质溶解度随温度变化、溶液中析出晶体的条件和溶质质量分数计算,做好该题的关键是注意图形结合,利用好溶解度和溶解度曲线及二者的关系.以及溶解度随温度的变化规律;了解饱和溶液中溶解度与溶质的质量分数的关系,题目难度中等.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
16.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 |
17.下列说法错误的是( )
| A. | 油脂可用于制造肥皂 | |
| B. | 小苏打可用于治疗胃酸过多 | |
| C. | 氢氧化铁胶体用于消毒净水 | |
| D. | 热的碳酸钠溶液可去除铜片表面的油污 |
1.在一定温度和体积下,使9.6gC和一定量的O2在一密闭容器中完全反应,(C与O2均没有剩余),测知容器内压强比反应前增大了0.60倍,则O2的物质量为( )
| A. | 0.40mol | B. | 0.50mol | C. | 0.60mol | D. | 0.70mol |
11.如图所示的实验操作中,正确的是( )
| A. |  摇匀 | B. |  给溶液加热 | C. |  滴加液体 | D. |  过滤 |
16.青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,下列叙述正确的是( )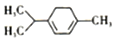

| A. | 该物质属于芳香族化合物,难溶于水 | |
| B. | 该物质可以发生消去、氧化、取代等反应 | |
| C. | 该分子结构中所有碳原子可能共平面 | |
| D. | 该有机物的一氯取代物有7种(不含立体结构) |