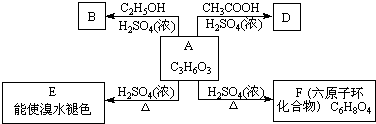
题目内容
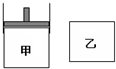 有两只密闭容器甲和乙.甲容器有一个可以移动的活塞能使容器内保持恒压,乙容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的M和N的混合气体,并使甲和乙容积相等(如右图所示).在保持400℃的条件下使之发生如下反应:2M(g)+N(g)?2Q(g),并达到平衡.下列说法正确的是( )
有两只密闭容器甲和乙.甲容器有一个可以移动的活塞能使容器内保持恒压,乙容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的M和N的混合气体,并使甲和乙容积相等(如右图所示).在保持400℃的条件下使之发生如下反应:2M(g)+N(g)?2Q(g),并达到平衡.下列说法正确的是( )| A、甲容器达到平衡时所需的时间比乙容器长 |
| B、平衡时甲容器中M的转化率比乙容器小 |
| C、平衡后,若向两容器中通入数量不多的等物质的量的氩气,甲容器中化学平衡向逆反应方向移动,乙容器中化学平衡不移动 |
| D、平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,甲容器的混合气体中Q的体积分数变小,乙容器的混合气体中Q的体积分数增大 |
考点:化学平衡的计算
专题:
分析:起始时向这两个容器中分别充入等物质的量的体积比为2:1的M和N的混合气体,反应向气体的物质的量减小的方向移动,甲容器有一个可以移动的活塞能使容器内保持恒压,乙容器能保持恒容,则甲的压强大于乙的压强,压强越大,反应速率越大,从压强对平衡移动的影响分析.
解答:
解:A、起始时向这两个容器中分别充入等物质的量的体积比为2:1的M和N的混合气体,反应向气体的物质的量减小的方向移动,甲容器有一个可以移动的活塞能使容器内保持恒压,乙容器能保持恒容,则甲的压强大于乙的压强,压强越大,反应速率越大,则甲达到平衡所需要的时间短,故A错误;
B、压强增大,平衡向生成Q的方向移动,乙容器中M的转化率小,故B错误;
C、达到平衡后,向两容器中分别通入等量的氩气,甲容器保持压强变化,则需增大体积,平衡向逆反应的方向移动,乙体积不变,氩气对平衡没有影响,故C正确;
D、恒温恒压容器甲中加入等量原反应物,最后达到相同平衡状态物质的质量分数不变;恒温恒容容器乙,加入原反应物压强增大,平衡正向进行,Q的体积分数增大,故D错误;
故选C.
B、压强增大,平衡向生成Q的方向移动,乙容器中M的转化率小,故B错误;
C、达到平衡后,向两容器中分别通入等量的氩气,甲容器保持压强变化,则需增大体积,平衡向逆反应的方向移动,乙体积不变,氩气对平衡没有影响,故C正确;
D、恒温恒压容器甲中加入等量原反应物,最后达到相同平衡状态物质的质量分数不变;恒温恒容容器乙,加入原反应物压强增大,平衡正向进行,Q的体积分数增大,故D错误;
故选C.
点评:本题考查化学平衡的影响因素,题目难度不大,注意计较两容器的不同状态,从压强对平衡移动的影响角度分析.

练习册系列答案
相关题目
下列气体中能用浓硫酸干燥的是( )
| A、H2S |
| B、NH3 |
| C、HI |
| D、CO2 |
98%的浓硫酸(密度为1.84g?cm-3)配制0.5mol?L-1的稀硫酸180mL,现给出下列仪器(配制过程中可能用到):①50mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤250mL容量瓶;⑥胶头滴管;⑦玻璃棒.配置过程一定需要使用的仪器是( )
| A、②③⑤⑥⑦ |
| B、③④⑤⑥⑦ |
| C、①②③⑤⑥⑦ |
| D、①③⑤⑥ |
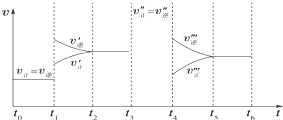 密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )
密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )| A、下列时刻所改变的外界条件是:t1升温;t3加催化剂;t4减压 |
| B、产物C的体积分数最大的时间段是t0~t1段 |
| C、上述图象中C的体积分数相等的时间段是t2~t3段与t3~t4段 |
| D、反应速率最大的时间段是t0~t1段 |
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,有关说法正确的是( )
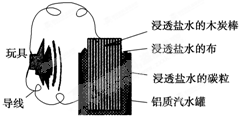

| A、铝罐将逐渐被腐蚀 |
| B、碳粒和炭棒上发生的反应为O2+4e-═2O2- |
| C、炭棒应与玩具电机的负极相连 |
| D、该电池工作一段时间后炭棒和碳粒的质量会减轻 |