题目内容
(1)铁钉在氯气中被锈蚀成棕黄色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2).则在Cl2、H+、Cl-、MnO4-中,具有氧化性的是 , 氧化性最强.
(2)在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,还原剂是 .若消耗19.2g还原剂,则被还原的氧化剂是 mol,HNO3表现 和 .
(2)在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,还原剂是
考点:氧化还原反应
专题:
分析:(1)同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(2)8HNO3+3Cu═3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价由0升高为+2价,N元素的化合价由+5价降低为+2价,以此来解答.
(2)8HNO3+3Cu═3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价由0升高为+2价,N元素的化合价由+5价降低为+2价,以此来解答.
解答:
解:(1)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,氧化剂为MnO4-,证明氧化性是Cl2>Fe3+,而在盐酸中生成浅绿色溶液(FeCl2),氧化剂为H+,
浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2),则证明氧化性是MnO4->Cl2,所以氧化性顺序是:MnO4->Cl2>Fe3+,所以氧化性最强的是MnO4-;
故答案为:Cl2、H+、MnO4-;MnO4-;
(2)8HNO3+3Cu═3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价升高,则Cu为还原剂,被氧化,对应的Cu(NO3)2为氧化产物;N元素的化合价降低,则HNO3为氧化剂,被还原,则NO为还原产物,
n(Cu)=
=0.3mol,由方程式可知当3molCu参加反应时,有2mol硝酸被还原,则0.3molCu参加反应,被还原的硝酸为0.2mol,反应中硝酸表现为氧化性和酸性.
故答案为:Cu;0.2;酸性;氧化性.
浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2),则证明氧化性是MnO4->Cl2,所以氧化性顺序是:MnO4->Cl2>Fe3+,所以氧化性最强的是MnO4-;
故答案为:Cl2、H+、MnO4-;MnO4-;
(2)8HNO3+3Cu═3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价升高,则Cu为还原剂,被氧化,对应的Cu(NO3)2为氧化产物;N元素的化合价降低,则HNO3为氧化剂,被还原,则NO为还原产物,
n(Cu)=
| 19.2g |
| 64g/mol |
故答案为:Cu;0.2;酸性;氧化性.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
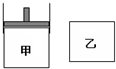 有两只密闭容器甲和乙.甲容器有一个可以移动的活塞能使容器内保持恒压,乙容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的M和N的混合气体,并使甲和乙容积相等(如右图所示).在保持400℃的条件下使之发生如下反应:2M(g)+N(g)?2Q(g),并达到平衡.下列说法正确的是( )
有两只密闭容器甲和乙.甲容器有一个可以移动的活塞能使容器内保持恒压,乙容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的M和N的混合气体,并使甲和乙容积相等(如右图所示).在保持400℃的条件下使之发生如下反应:2M(g)+N(g)?2Q(g),并达到平衡.下列说法正确的是( )| A、甲容器达到平衡时所需的时间比乙容器长 |
| B、平衡时甲容器中M的转化率比乙容器小 |
| C、平衡后,若向两容器中通入数量不多的等物质的量的氩气,甲容器中化学平衡向逆反应方向移动,乙容器中化学平衡不移动 |
| D、平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,甲容器的混合气体中Q的体积分数变小,乙容器的混合气体中Q的体积分数增大 |
已知:C(s)+O2(g)=CO2(g)△H1
CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3
4Fe(s)+3O2(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3
4Fe(s)+3O2(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A、△H1>0,△H2>0 |
| B、△H3<0,△H4>0 |
| C、△H3=△H1-△H2 |
| D、△H4=2△H5-3△H3 |
下列有关实验的说法不正确的是( )
| A、当沉淀的颗粒较大时,也可用倾析法将固体和溶液分离 |
| B、结晶时,若溶质的溶解度越大,或溶液的浓度越高、或溶剂的蒸发速度越快,析出的晶粒就越细小 |
| C、利用硝酸和硝酸银溶液可区分工业盐和食盐 |
| D、制备阿司匹林时可能混有少量的聚合物杂质,可用碳酸氢钠溶液进行提纯 |
据长沙晚报报道:长沙市的夜市小吃摊上有人在卖“纯人工鸡蛋”.国务院明确该食品存在安全隐患必须召回.人造鸡蛋所用的都是化学成分.人造鸡蛋的蛋壳是用碳酸钙做的,蛋黄和蛋清则是用海藻酸钠、明矾、明胶、食用氯化钙加水、色素等制成.下列判断正确的是( )
| A、“人造鸡蛋”蛋清在硫化铵、硫酸钠溶液中发生盐析,在硫酸铜溶液中变性 |
| B、“人造鸡蛋”在食醋中可能变软,有气泡产生 |
| C、长期食用“人造鸡蛋”可以补钙,强身健体 |
| D、“人造鸡蛋”长期放置会变质,有硫化氢生成 |
在无色、碱性溶液中能大量共存的一组离子是( )
| A、Ca2+、Na+、SO42-、HCO3- |
| B、K+、Fe2+、SO42-、MnO4- |
| C、Ba2+、K+、Al3+、Cl- |
| D、Na+、Ba2+、Cl-、NO3- |
2014年我国纪念“世界水日”活动的宣传主题为“加强河湖管理,建设水生态文明”.下列与水相关的叙述正确的是( )
| A、加聚反应也可能有水生成 |
| B、有水参加的有机化学反应都可以叫做水解反应 |
| C、水可以参与有些有机反应,有些有机反应也有水生成 |
| D、水、乙醇、氢氧化钠中都存在羟基 |