题目内容
不能证明HCN是弱电解质的是( )
| A、1mol.L-1氢氯酸(HCN)的pH约为3 |
| B、常温下,pH=4的氢氯酸稀释100倍后所得溶液pH<6 |
| C、10mL 1 mol.L-1氢氯酸(HCN)恰好与10mL 1 mol.L-1NaOH溶液完全反应 |
| D、常温下,0.1mol.L-1NaCN溶液的pH约为10 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:氢氰酸为弱电解质,则利用其电离不完全来分析,一般测定溶液的pH或测定相同条件下与强酸的导电性比较以及对应盐溶液的酸碱性来判断,以此解答该题.
解答:
解:A.氢氰酸为一元酸,1mol/L氢氰酸溶液的pH=0时该酸为强酸,但pH约为3,说明电离生成的氢离子约为10-3mol/L<1mol/L,电离不完全,故A不选;
B.常温下,pH=4的HCN稀释100倍后所得溶液pH<6,可说明HCN在加水稀释时进一步电离,为弱电解质,故B不选;
C.二者物质的量相等,不能证明酸性的强弱,故C选;
D.NaCN溶液呈碱性,说明为强碱弱酸盐,则HCN为弱酸,故D不选.
故选C.
B.常温下,pH=4的HCN稀释100倍后所得溶液pH<6,可说明HCN在加水稀释时进一步电离,为弱电解质,故B不选;
C.二者物质的量相等,不能证明酸性的强弱,故C选;
D.NaCN溶液呈碱性,说明为强碱弱酸盐,则HCN为弱酸,故D不选.
故选C.
点评:本题考查弱电解质的判断方法,明确弱电解质在水中电离不完全是解答本题的关键,学生应注意在平时的学习中归纳判断弱电解质的方法,难度不大.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
下列实验误差分析错误的是( )
| A、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| B、酸碱中和滴定时用待测液润洗锥形瓶,所测结果偏高 |
| C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D、测定中和反应的反应热时,将碱缓慢倒入酸中,所测最高温度值偏大 |
有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
| A、4种溶液pH的大小顺序:①>④>③>② |
| B、溶液①、②等体积混合后pH>7,则c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别加入25 mL 0.1mol/L 盐酸后,溶液中c(NH4+):①>② |
| D、向溶液③、④中分别加入25mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同 |
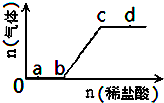 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列粒子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:Na+、SO42-、NO3-、Fe(OH)3胶体微粒 |
| B、b点对应的溶液中:Al3+、H+、MnO4-、Cl- |
| C、c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D、d点对应的溶液中:F-、NO3-、Fe2+、Ag+ |
在含有Fe3+、Al3+、Fe2+、NH4+的溶液中,加入足量的Na202固体,充分反应后,再加入过量的稀盐酸,完全反应后,溶液中离子数目没有变化的是( )
| A、Fe3+ | ||
| B、Fe2+ | ||
| C、Al3+ | ||
D、N
|
下列说法不正确的是( )
| A、硅单质可用于光纤通讯 |
| B、由SiO2制取硅酸,可先使SiO2与NaOH溶液反应,再通入CO2 |
| C、青石棉[Na2Fe5Si8O22(OH)2]的化学组成可表示为:Na2O?3FeO?Fe2O3?8SiO2?H2O |
| D、Na2SiO3可用于制备木材防火剂 |
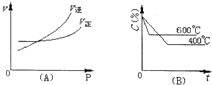 如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、N2O3(g)?NO2(g)+NO(g)△H>0 |
| B、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 |
| C、3NO2(g)+H2O(I)?2HNO3(I)+NO(g)△H<0 |
| D、CO2(g)+C(s)?2CO(g)△H>0 |
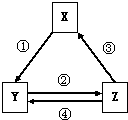 下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )