题目内容
8.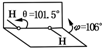 我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )
我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2是极性分子 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
分析 A、因结构也没有发生改变,所以尿素 (H2NCONH2)和H2O2通过氢键形成加合物H2NCONH2•H2O2,不是形成化学键;
B、根据H2O2的正负电荷中心不重合;
C、H2O2的氧元素的化合价为-1价,处于氧元素的中间价态;
D、由非金属元素形成的化合物绝大多数为共价化合物.
解答 解:A、因结构也没有发生改变,所以尿素 (H2NCONH2)和H2O2通过氢键形成加合物H2NCONH2•H2O2,而是尿素 (H2NCONH2)和H2O2通过氢键形成加合物H2NCONH2•H2O2,故A正确;
B、根据H2O2的正负电荷中心不重合,所以H2O2是极性分子,故B正确;
C、H2O2的氧元素的化合价为-1价,处于氧元素的中间价态,既有氧化性又有还原性,故C正确;
D、除了铵盐外,由非金属元素形成的化合物绝大多数为共价化合物,故H2NCONH2•H2O2为共价化合物,故D错误.
故选D.
点评 本题考查了新型化合物的结构和性质,容易出错的是A,应注意的是由于双氧水的结构也没有发生改变,这说明是通过氢键连接的.

练习册系列答案
相关题目
19.NA为阿伏伽德罗常数,下列叙述错误的是( )
| A. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| B. | 1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子 | |
| C. | 由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA | |
| D. | 6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
20.下列反应的离子方程式书写正确的是( )
| A. | 钠和水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 碳酸钙与稀醋酸的反应:CO32-+2H+═CO2↑+H2O | |
| C. | 铜与稀硝酸的反应:Cu+2H+═Cu2++H2↑ | |
| D. | 常温下,用氢氧化钠溶液吸收多余的氯气:Cl2+OH-═Cl-+ClO-+H2O |
17.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.下列叙述正确的是( )
| A. | 上述反应中硫元素只被氧化 | |
| B. | Na2S2O3在强酸性环境中能稳定存在 | |
| C. | 每生成1 molNa2S2O3,转移电子数为4NA | |
| D. | 若将Na2CO3换成Na2SO3(配比不变),每吸收3 molSO2,理论上就会生成3mol Na2S2O3 |
18.下列关于原电池的叙述中,正确的是( )
| A. | 在铜锌原电池中,铜作负极 | |
| B. | 在铜锌原电池中,锌作阴极 | |
| C. | 原电池是将化学能转化为电能的装置 | |
| D. | 原电池是将电能转化为化学能的装置 |