题目内容
17.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.下列叙述正确的是( )| A. | 上述反应中硫元素只被氧化 | |
| B. | Na2S2O3在强酸性环境中能稳定存在 | |
| C. | 每生成1 molNa2S2O3,转移电子数为4NA | |
| D. | 若将Na2CO3换成Na2SO3(配比不变),每吸收3 molSO2,理论上就会生成3mol Na2S2O3 |
分析 工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,其反应方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应在S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,以此解答该题.
解答 解:A.由反应方程式中S元素的化合价变化可知,硫元素既被氧化又被还原,故A错误;
B.Na2S2O3在强酸性环境中发生歧化反应生成硫和二氧化硫气体,故B错误;
C.反应中Na2S转化为Na2S2O3,转移8个电子,则生成1molNa2S2O3,转移$\frac{8}{3}$mol电子,故C错误;
D.根据方程式可知,将Na2CO3换成Na2SO3(配比不变),发生2Na2S+Na2SO3+3SO2═3Na2S2O3,每吸收3molSO2,理论上就会生成3mol Na2S2O3,故D正确.
故选D.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意从元素的化合价角度分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.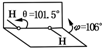 我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )
我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )
 我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )
我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,有关过氧化氢的说法不正确的是( )| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2是极性分子 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
12.在强酸性溶液中可大量共存的离子组是( )
| A. | Na+、K+、Cl-、F- | B. | Fe2+、ClO-、NO3-、Na+ | ||
| C. | Fe2+、Mg2+、SO42-、Cl- | D. | CO32-、SO42-、Na+、K+ |
6.相同浓度的下列溶液中,酸性最强的是( )
| A. | NaHSO4 | B. | NaHSO3 | C. | NaHCO3 | D. | CH3COOH |
7.下列物质的分类合理的是( )
| A. | 盐:Ca(ClO)2 NH4NO3 K2SiO3 | |
| B. | 酸性氧化物:Al2O3 K2O CO2 | |
| C. | 电解质:HCl Ba(OH)2 CO | |
| D. | 非电解质:Cl2 NO 乙醇(C2H5OH) |
