题目内容
17.对于有机物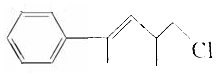 的下列叙述中不正确的是( )
的下列叙述中不正确的是( )| A. | 分子式是C12H15Cl,属于卤代烃 | |
| B. | 1mol该物质最多能与4molH2发生加成反应 | |
| C. | 既能使溴水褪色,又能使KMnO4 酸性溶液褪色 | |
| D. | 该溶液与酸化的AgNO3 溶液混合时会产生白色沉淀 |
分析 由结构可知分子式,分子中含C、H、Cl元素,含碳碳双键、-Cl,结合烯烃、卤代烃的性质来解答.
解答 解:A.分子式是C12H15Cl,含C、H、Cl元素,属于卤代烃,故A正确;
B.苯环与碳碳双键与氢气发生加成反应,则1mol该物质最多能与4molH2发生加成反应,故B正确;
C.含碳碳双键,既能使溴水褪色,又能使KMnO4 酸性溶液褪色,故C正确;
D.含-Cl,不能电离出氯离子,与硝酸银不反应,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意烯烃、卤代烃的性质,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
8.下列有关离子方程式正确的是( )
| A. | 向稀盐酸中加入少量金属钠:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 向氯化铁溶液中滴加碳酸氢钠溶液:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑ | |
| C. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O | |
| D. | 将过量的SO2通入漂白粉溶液中:Ca2++2ClO-+2SO2+2H2O═CaSO4↓+2Cl-+4H++SO42- |
5.用激光笔分别照射下列各烧杯中的液体,能在与光束垂直的方向上观察到一条光亮“通路”的是( )
| A. | 泥水 | B. | 蒸馏水 | C. | 硫酸铜溶液 | D. | 氢氧化铁胶体 |
12.分子式为C8H8的有机物X,X核磁共振氢谱显示只有一个吸收峰,下列相关说法正确的是( )
| A. | X是乙烯 | B. | X能使溴水褪色 | ||
| C. | X属于不饱和烃 | D. | X的二氯代物有三种 |
2.在向盛有氯化铁溶液的烧杯中加入过量铜粉,反应结束后过滤,对溶液中大量存在的金属阳离子的成分判断正确的是( )
| A. | 只有Cu2+ | B. | Fe2+、Cu2+ | C. | Fe3+、Fe2+ | D. | Fe3+、Cu2+ |
9.下列离子方程式的书写正确的是( )
| A. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| B. | H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 将Na投入到CuSO4溶液中:2Na+Cu2+═2Na++Cu↓ | |
| D. | 将Cl2通入水中:Cl2+H2O═2H-+Cl-+ClO- |
6.下列物质中既含有离子键又含有共价键的是( )
| A. | NH4Cl | B. | NaCl | C. | H2O | D. | Cl2 |

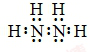 ;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-
;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-