题目内容
氢化铵(NH4H)与氯化铵的结构相似,又知它与水反应有气体生成.下列关于氢化铵叙述不正确的是( )
| A、是离子化合物,含有离子键和共价键 |
B、电子式是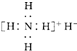 |
| C、与水反应时,是还原反应 |
| D、固体投入少量的水中,有两种气体产生 |
考点:铵盐
专题:
分析:A.NH4H是铵根离子与氢负离子通过离子键形成的离子化合物,属于离子晶体;
B、NH4H是离子化合物,由铵根离子与氢负离子构成;
C、化合价升高元元素发生氧化反应;
D、NH4H固体投入少量水中,可生成NH3和H2.
B、NH4H是离子化合物,由铵根离子与氢负离子构成;
C、化合价升高元元素发生氧化反应;
D、NH4H固体投入少量水中,可生成NH3和H2.
解答:
解:A.NH4H与氯化铵的结构相似,是由NH4+和H-构成的离子化合物,故A正确;
B、NH4H是离子化合物,由铵根离子与氢负离子构成,电子式为 ,故B错误;
,故B错误;
C、NH4H中含有-1价H,与水反应时发生氧化还原生成氢气,NH4H为还原剂,发生氧化反应,故C错误;
D.NH4H固体投入少量水中,可生成NH3和H2,故D正确.
故选BC.
B、NH4H是离子化合物,由铵根离子与氢负离子构成,电子式为
 ,故B错误;
,故B错误;C、NH4H中含有-1价H,与水反应时发生氧化还原生成氢气,NH4H为还原剂,发生氧化反应,故C错误;
D.NH4H固体投入少量水中,可生成NH3和H2,故D正确.
故选BC.
点评:本题考查氧化还原反应,题目难度不大,注意元素化合价的判断,为解答该题的关键,根据元素化合价的变化判断物质在反应中具有的性质.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、CO32-、SO32-、SO42-中的若干种离子.某同学对该溶液进行了如下实验:下列判断正确的是( )


| A、气体甲一定是纯净物 |
| B、沉淀甲是硅酸和硅酸镁的混合物 |
| C、一定存在K+、[Al(OH)4]-和SiO32- |
| D、一定不存在CO32-和SO42- |
常温下,下列溶液的离子浓度关系式正确的是( )
| A、pH=4的氯化铵溶液中,c(H+)=c(NH3?H2O)=1×l0-4 mol?L-1 |
| B、pH=a的HCl溶液,稀释10倍后,其pH=b,则a=b+l |
| C、pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) |
| D、pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①<② |
下列能用勒沙特列原理解释的是( )
| A、由二氧化硫和氧气反应制三氧化硫需要使用催化剂 |
| B、棕红色NO2加压后颜色先变深后变浅 |
| C、SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D、H2、I2、HI平衡混合气加压后颜色变深 |
已知X、Y分别为同周期的ⅠA和 VIA族的两种元素,它们的原子序数分别为a和b,则下列关系不可能成立的是( )
| A、a=b-15 |
| B、a=b-29 |
| C、a=b-9 |
| D、a=b-5 |

 如图是实验室制取和收集氨气的装置图.回答下列问题:
如图是实验室制取和收集氨气的装置图.回答下列问题:
 .
.