题目内容
请指出下列过程需要破坏的作用力
①离子键 ②极性共价键 ③非极性共价键 ④氢键 ⑤分子间作用力
(1)干冰熔化 ;
(2)氢氧化钠溶于水 ;
(3)过氧化钠溶于水 ;
(4)氯化氢气体溶于水 ;
(5)冰熔化 .
①离子键 ②极性共价键 ③非极性共价键 ④氢键 ⑤分子间作用力
(1)干冰熔化
(2)氢氧化钠溶于水
(3)过氧化钠溶于水
(4)氯化氢气体溶于水
(5)冰熔化
考点:化学键和分子间作用力的区别
专题:
分析:(1)干冰熔化是分子晶体,熔化属于物理变化,需要破坏分子间作用力;
(2)氢氧化钠是离子化合物,溶于水发生电离生成钠离子和氢氧根离子,破坏离子键;
(3)过氧化钠是含有离子键和非极性共价键的离子化合物,溶于水生成氢氧化钠和氧气,需要破坏离子键和非极性共价键;
(4)氯化氢气体含有极性共价键H-Cl键,溶于水发生电离,破坏了极性共价键;
(5)冰属于分子晶体,分子间含有氢键和分子间作用力,熔化时需要破坏氢键和分子间作用力.
(2)氢氧化钠是离子化合物,溶于水发生电离生成钠离子和氢氧根离子,破坏离子键;
(3)过氧化钠是含有离子键和非极性共价键的离子化合物,溶于水生成氢氧化钠和氧气,需要破坏离子键和非极性共价键;
(4)氯化氢气体含有极性共价键H-Cl键,溶于水发生电离,破坏了极性共价键;
(5)冰属于分子晶体,分子间含有氢键和分子间作用力,熔化时需要破坏氢键和分子间作用力.
解答:
解:(1)干冰熔化是分子晶体,熔化属于物理变化,需要破坏分子间作用力,
故答案为:⑤;
(2)氢氧化钠是离子化合物,溶于水发生电离生成钠离子和氢氧根离子,破坏离子键,
故答案为:①;
(3)过氧化钠是含有离子键和非极性共价键的离子化合物,溶于水生成氢氧化钠和氧气,需要破坏离子键和非极性共价键,
故答案为:①③;
(4)氯化氢气体含有极性共价键H-Cl键,溶于水发生电离,破坏了极性共价键,
故答案为:②;
(5)冰属于分子晶体,分子间含有氢键和分子间作用力,熔化时需要破坏氢键和分子间作用力,
故答案为:④⑤.
故答案为:⑤;
(2)氢氧化钠是离子化合物,溶于水发生电离生成钠离子和氢氧根离子,破坏离子键,
故答案为:①;
(3)过氧化钠是含有离子键和非极性共价键的离子化合物,溶于水生成氢氧化钠和氧气,需要破坏离子键和非极性共价键,
故答案为:①③;
(4)氯化氢气体含有极性共价键H-Cl键,溶于水发生电离,破坏了极性共价键,
故答案为:②;
(5)冰属于分子晶体,分子间含有氢键和分子间作用力,熔化时需要破坏氢键和分子间作用力,
故答案为:④⑤.
点评:本题考查了化学键和分子间作用力的区别,难度一般,掌握具体物质所含化学键类型以及分子间作用力是解题的关键.

练习册系列答案
相关题目
能用键能知识加以解释的是( )
| A、稀有气体的化学性质很不活泼 |
| B、HCl气体比HI气体稳定 |
| C、干冰易升华 |
| D、氮气的化学性质很稳定 |
下列物质的溶液在蒸发皿中加热蒸干并灼烧,最后得到该物质固体的是( )
| A、氯化铝 | B、硫酸镁 |
| C、亚硫酸钠 | D、碳酸氢钠 |
氢化铵(NH4H)与氯化铵的结构相似,又知它与水反应有气体生成.下列关于氢化铵叙述不正确的是( )
| A、是离子化合物,含有离子键和共价键 |
B、电子式是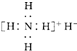 |
| C、与水反应时,是还原反应 |
| D、固体投入少量的水中,有两种气体产生 |
下列事实能用电化学原理解释的是( )
| A、银质物品久置表面变暗 |
| B、远洋海轮的尾部装上一定数量的锌板 |
| C、常温条件下,在空气中铝不易被腐蚀 |
| D、用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |
下列关于化学键的说法正确的是( )
| A、由于金属键具有方向性与饱和性,所以金属在外加电场作用下导电 |
| B、金属键是金属阳离子与自由电子间的相互作用 |
| C、氢键、配位键都是特殊的共价键 |
| D、离子晶体中只存在离子键 |
氯的原子序数为17,氯有两种同位素 37Cl、35Cl.下列说法正确的是( )
| A、35Cl原子所含质子数为18 | ||
B、
| ||
| C、3.5g35Cl2气体的体积为1.12L | ||
| D、已知自然界中氯元素的平均相对原子质量为35.5,则37Cl的质量分数为25% |
 已知25℃时有关弱酸的电离平衡常数:
已知25℃时有关弱酸的电离平衡常数: