题目内容
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、CO32-、SO32-、SO42-中的若干种离子.某同学对该溶液进行了如下实验:下列判断正确的是( )


| A、气体甲一定是纯净物 |
| B、沉淀甲是硅酸和硅酸镁的混合物 |
| C、一定存在K+、[Al(OH)4]-和SiO32- |
| D、一定不存在CO32-和SO42- |
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:能和盐酸反应获得气体的是碳酸根或是亚硫酸根离子,会生成沉淀的是硅酸根离子,碳酸根离子和镁离子以及铝离子不能共存于溶液中,能和过量的氨水反应生成的白色沉淀只能是氢氧化铝,偏铝酸根离子和过量的盐酸反应会生成铝离子,根据离子之间的反应以及实验现象确定存在的离子.
解答:
解:加HCl有气体说明有CO32-、SO32-中的至少一种离子,生成的气体可以是二氧化碳、或是二氧化硫或是二者的混合物,一定不存在和碳酸根或是亚硫酸根不共存的离子,所以不存在镁离子、铝离子,加盐酸有沉淀,说明一定有硅酸根离子,硅酸是沉淀,加入过量氨水(提供OH-)有沉淀生成,只能是氢氧化铝沉淀,说明此时溶液中存在铝离子,但是原来溶液中的铝离子一定不能存在,所以该铝离子是偏铝酸根离子和盐酸反应生成的,所以,一定存在偏铝酸根离子,要保证溶液电中性,只有K+这一个阳离子,所以一定存在钾离子.
A、加HCl有气体说明有CO32-、CO32-中的至少一种离子,生成的气体可以是二氧化碳、或是二氧化硫或是二者的混合物,故A错误;
B、溶液中一定含有CO32-、SO32-中的至少一种离子,则一定不含有镁离子,它们和镁离子不共存,所以沉淀甲是硅酸,不可能是硅酸镁,故B错误;
C、根据上述推断,溶液中一定含有K+、AlO2-和SiO32-,故C正确;
D、碳酸根和硫酸根离子是否存在不能确定,故D错误.
故选C.
A、加HCl有气体说明有CO32-、CO32-中的至少一种离子,生成的气体可以是二氧化碳、或是二氧化硫或是二者的混合物,故A错误;
B、溶液中一定含有CO32-、SO32-中的至少一种离子,则一定不含有镁离子,它们和镁离子不共存,所以沉淀甲是硅酸,不可能是硅酸镁,故B错误;
C、根据上述推断,溶液中一定含有K+、AlO2-和SiO32-,故C正确;
D、碳酸根和硫酸根离子是否存在不能确定,故D错误.
故选C.
点评:本题涉及离子的检验和离子共存等方面的知识,注意离子的特征离子反应是解决该问题的关键所在,综合性强,难度大.

练习册系列答案
相关题目
可用来分离Fe3+和Al3+两种离子的试剂是下列的 ( )
| A、盐酸 | B、氢氧化钠溶液 |
| C、氨水 | D、硫氰化钾溶液 |
下列反应不属于取代反应的是( )
A、CH4+Cl2
| |||
B、 +Br2 +Br2
 +HBr +HBr | |||
C、CH3CH2OH+CH3COOH
| |||
| D、CH2═CH2+HBr→CH3CH2Br |
下列物质中不会因见光而分解的是( )
| A、NaHCO3 |
| B、HNO3 |
| C、HClO |
| D、AgBr |
用浓硫酸可以干燥的气体有( )
| A、氨气 | B、氢气 | C、碘化氢 | D、氯气 |
 阿斯巴甜(Aspartame,结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍.下列关于阿斯巴甜的说法错误的是( )
阿斯巴甜(Aspartame,结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍.下列关于阿斯巴甜的说法错误的是( )| A、分子式为C14H18N2O5,属于蛋白质 |
| B、酸性条件下的水解产物中有两种氨基酸 |
| C、在一定条件下能发生取代反应、加成反应 |
| D、在一定条件下能与酸反应、不能与碱反应 |
能用键能知识加以解释的是( )
| A、稀有气体的化学性质很不活泼 |
| B、HCl气体比HI气体稳定 |
| C、干冰易升华 |
| D、氮气的化学性质很稳定 |
氢化铵(NH4H)与氯化铵的结构相似,又知它与水反应有气体生成.下列关于氢化铵叙述不正确的是( )
| A、是离子化合物,含有离子键和共价键 |
B、电子式是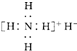 |
| C、与水反应时,是还原反应 |
| D、固体投入少量的水中,有两种气体产生 |
