题目内容
13.下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是( )| A. | Cu(OH)2+HCl Cu(OH)2+CH3COOH | |
| B. | NaHCO3+H2SO4 Na2CO3+HCl | |
| C. | NaHCO3+NaOH Ca(HCO3)2+NaOH | |
| D. | BaCl2+H2SO4 Ba(NO3)2+H2SO4 |
分析 A.CH3COOH为弱酸,应写成化学式,HCl为强电解质,写成离子;
B.NaHCO3电离出HCO3-,Na2CO3电离出CO32-;
C.Ca(HCO3)2和NaOH反应生成CaCO3沉淀;
D.反应的实质为SO42-和Ba2+的反应.
解答 解:A.Cu(OH)2+HCl的离子方程式分别为:Cu(OH)2+2H+=Cu2++2H2O,Cu(OH)2+CH3COOH的Cu(OH)2+2CH3COOH=Cu2++2H2O+2CH3COO-,两个离子方程式不同,故A错误;
B.Na2CO3电离出CO32-,NaHCO3电离出HCO3-,反应的离子方程式分别为:2H++CO32-=H2O+CO2↑、H++HCO3-=H2O+CO2↑,故B错误;
C.碳酸氢钠与氢氧化钠反应生成碳酸钠和水,而Ca(HCO3)2和NaOH反应生成CaCO3沉淀,生成物不同,离子方程式不同,故C错误;
D.实质都为SO42-和Ba2+的反应,离子方程式都为:SO42-+Ba2+=BaSO4↓,故D正确;
故选D.
点评 本题考查离子方程式的书写,题目难度不大,明确离子方程式表示的意义为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
3.某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、HCO3-、Na+、K+、Mg2+,所含离子的浓度均相等.为了确认溶液的组成,进行如下实验:取200mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g,向沉淀中加入过量的盐酸,有2.33g.关于原溶液组成的结论,不正确的是( )
| A. | 一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 为了确定是否存在Cl-,可向溶液中加入硝酸酸化的硝酸银溶液 | |
| C. | c(HCO3-)=0.05mol/L | |
| D. | 4.88g沉淀中含有3种成分 |
4.下列反应的离子方程式书写正确的是( )
| A. | 铜溶于0.5 mol•L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向NH4HSO4溶液中滴加少量Ba(OH)2的溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO42-+5H2C2O4=2Mn2++10CO2↑+2H2O+6OH- |
8.常温下,往5%的H2O2溶液中滴加2~3滴FeCl3溶液,可发生如下两个反应:
①2Fe3++H2O2═2Fe2++O2↑+2H+②2Fe2++H2O2+2H+═2Fe3++2H2O
下列说法不正确的是( )
①2Fe3++H2O2═2Fe2++O2↑+2H+②2Fe2++H2O2+2H+═2Fe3++2H2O
下列说法不正确的是( )
| A. | Fe3+在反应①中作氧化剂,在反应②中为氧化产物 | |
| B. | 若生成标准状况下22.4 L O2,则整个过程中转移电子总数为2 mol | |
| C. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| D. | 在工业生产H2O2过程中要严格避免混入Fe3+ |
18.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.则叙述不正确的是( )

| A. | 迷迭香酸属于芳香族化合物 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、取代反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应 |
5.下列说法正确的是( )
| A. | 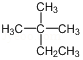 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 用酸性KMnO4溶液可以确定CH2=CH-CHO中含有C=C双键 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 |
3.下列实验环节错误的是( )
| A. | 块状固体药品的取用:一横、二放、三慢竖 | |
| B. | 液体药品的倾倒:瓶塞倒放、紧挨瓶口、缓慢倒入 | |
| C. | 分液的操作:静置分层后将分液漏斗中下层液从下口放出,再将上层液从上口倒出 | |
| D. | 冷凝管的使用:冷却水下口进,上口出 |