题目内容
8.设NA表示阿伏加德罗常数,下列叙述中正确的是( )①31g白磷含有的P-P键数为NA ②1mol CH3+(碳正离子)中含有电子数为9NA
③1mol铜与足量硫蒸气反应,转移电子数为2NA ④用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA⑤0.84g NaHCO3晶体中阳离子和阴离子总数为0.03NA ⑥3.9g Na2O2吸收足量的CO2时转移的电子数是0.05NA.
| A. | ①④⑥ | B. | ④⑥ | C. | ②③④ | D. | ②④⑥ |
分析 ①求出白磷的物质的量,然后根据1mol白磷中含6molP-P键来分析;
②1mol CH3+(碳正离子)中含8mol电子;
③铜与硫蒸气反应铜元素变为+1价;
④求出32g铜的物质的量,然后根据当生成1mol铜时,转移2mol电子来分析;
⑤求出0.84g NaHCO3晶体的物质的量,然后根据碳酸氢钠中含1个钠离子和1个碳酸氢根来分析;
⑥求出3.9g Na2O2的物质的量,然后根据过氧化钠与二氧化碳的反应为歧化反应来分析.
解答 解:①31g白磷的物质的量为n=$\frac{31g}{(31×4)g/mol}$=0.25mol,而1mol白磷中含6molP-P键,故0.25mol白磷中含1.25molP-P键即1.25NA个,故①错误;
②1mol CH3+(碳正离子)中含8mol电子即8NA个,故②错误;
③铜与硫蒸气反应铜元素变为+1价,故1mol铜转移1mol电子即NA个,故③错误;
④32g铜的物质的量为0.5mol,故当生成1mol铜时,转移2mol电子,故0.5mol铜转移1mol电子即NA个,故④正确;
⑤0.84g NaHCO3晶体的物质的量为0.01mol,而碳酸氢钠中含1个钠离子和1个碳酸氢根,故0.01mol碳酸氢钠中含0.02mol离子,即0.02NA个,故⑤错误;
⑥3.9g Na2O2的物质的量为0.05mol,而过氧化钠与二氧化碳的反应为歧化反应,故0.05mol过氧化钠转移0.05mol电子即0.05NA个,故⑥正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.下列有关仪器使用方法或实验操作正确的是( )
| A. | 洗净的滴定管和容量瓶可以放进烘箱中烘干 | |
| B. | 用10mL量筒量取10.00mLNaCl溶液 | |
| C. | 酸式滴定管装标准溶液前,必须先用该溶液润洗2~3次 | |
| D. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 |
16.下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、CO32- | |
| C. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| D. | 含有大量NaClO的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
3.氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解.某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用下图I装置制取氨气,可选择的试剂是浓氨水与氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰).
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中. 当悬浮物较多时,停止制备.
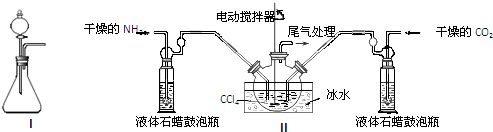
注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
②根据①的结论:取氨基甲酸铵样品6.58g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为3.94g.则样品中氨基甲酸铵的质量分数为76%..
[保留两位有效数字,已知Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197].
(1)如用下图I装置制取氨气,可选择的试剂是浓氨水与氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰).
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中. 当悬浮物较多时,停止制备.

注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入少量澄清石灰水. | 溶液变浑浊,证明固体中含有碳酸氢铵. |
[保留两位有效数字,已知Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197].
20.化学与人类生活、能源开发、资源利用等密切相关.下列说法正确的是( )
| A. | 聚氯乙烯塑料制品可用于食品包装 | |
| B. | H7N9型禽流感病毒在高温条件下被杀死的过程是蛋白质变性 | |
| C. | 高纯度的硅单质用于制作光导纤维,光导纤维有导电性 | |
| D. | 研发使用高效催化剂,可提高反应中原料的转化率 |
17.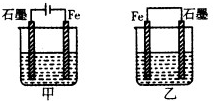 如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )
如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )
 如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )
如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )| A. | A、甲乙两装置中的石墨电极分别是阴极、负极 | |
| B. | 铁棒的腐蚀程度:甲>乙 | |
| C. | 石墨电极上发生反应的电极反应式相同 | |
| D. | 溶液的pH:甲减小,乙增大 |
18.已知有如下反应:①2BrO3-+Cl2═Br2+2ClO3-,②2FeCl2+Cl2═2FeCl3,③2FeCl3+2KI═2FeCl2+2KCl+I2,④ClO3-+5Cl-+6H+═3Cl2+3H2O,下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl 2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
 在如图所示的物质转化关系中,A是一种活泼金属,B是常见的无色液体,在常温下C、E都是气体.请回答下列问题:
在如图所示的物质转化关系中,A是一种活泼金属,B是常见的无色液体,在常温下C、E都是气体.请回答下列问题: .
. 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下: