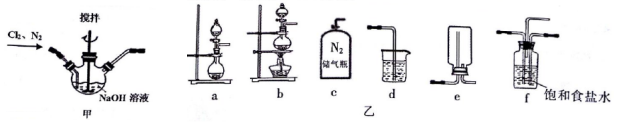
题目内容
18.下列说法正确的是( )| A. | 钠在硫酸铁溶液中可置换出铁 | B. | 铜在硝酸银溶液中可置换出银 | ||
| C. | 铁不与H2O反应 | D. | 氢在空气中会自燃 |
分析 A.钠易和水反应;
B.铜比银活泼;
C.加热条件下铁与水蒸气反应;
D.氢在点燃条件下与氧气反应.
解答 解:A.钠在硫酸铁溶液中,可生成氢氧化铁、氢气,故A错误;
B.铜比银活泼,可置换出银,故B正确;
C.加热条件下铁与水蒸气反应,可生成四氧化三铁和氢气,故C错误;
D.氢在点燃条件下与氧气反应,如氢气在空气中点燃,可爆炸,故D错误.
故选B.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握相关基础知识的积累,难度不大.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
8.在标准状况下,气态分子断开1mol化学键的焓称为键焓.已知几种化学键的键焓如下表所示:
下列说法正确的是( )
| 化学键 | C-C | C═C | C≡C | C-H | H-H | Cl-Cl | H-Cl |
| 键焓(△H)/kJ•mol-1 | 347.7 | 615.0 | 812.0 | 413.4 | 436.0 | 242.7 | 431 |
| A. | CH2═CH2(g)+H2(g)→CH3CH3(g)△H=+123.5 kJ•mol-1 | |
| B. | CH≡CH(g)+2H2(g)→CH3CH3(g)△H=-317.3 kJ•mol-1 | |
| C. | 稳定性:H-H键<H-Cl键<C-H键 | |
| D. | 由上表数据可计算乙烷与氯气发生一氯代反应的焓变(△H) |
13.现有氯化钠、氯化铝、氯化铁、氯化镁四种溶液,只用一种试剂通过一步实验就能加从区别,这种试剂是
( )
( )
| A. | KSCN溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | HCl溶液 |
10.下列有关实验现象或结论的描述不正确的是( )
| A. | FeCl2溶液与K3[Fe(CN)6]混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| B. | 向饱和食盐水中加入少量浓盐酸,看到溶液振荡,溶液变浑浊 | |
| C. | 某温度下,向AgCl饱和溶液中加入蒸馏水,AgCl的溶解度、Ksp均增大 | |
| D. | 处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
7.将铁屑溶于过量盐酸后,再加入下列物质:①稀硫酸;②硝酸钠;③氯化铜;④氯水,产生 Fe3+的是( )
| A. | ①④ | B. | ②④ | C. | 只有④ | D. | ①③ |
1.下列溶液中浓度关系正确的是( )
| A. | 小苏打溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | CH3COONa溶液中:c(CH3COO-)>c(Na+) | |
| C. | 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 常温下,0.1mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-) |
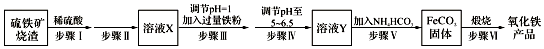
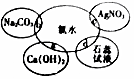 氯水具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(已知反应中氯水足量)
氯水具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(已知反应中氯水足量)