题目内容
1.下列溶液中浓度关系正确的是( )| A. | 小苏打溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | CH3COONa溶液中:c(CH3COO-)>c(Na+) | |
| C. | 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 常温下,0.1mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-) |
分析 A.小苏打是碳酸氢钠的俗称,溶液中存在电荷守恒,根据电荷守恒判断;
B.醋酸钠溶液中醋酸根离子水解导致溶液呈碱性,结合电荷守恒判断c(CH3COO-)、c(Na+)相对大小;
C.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.0.1mol/L的NaHA溶液呈酸性,说明HA-的电离程度大于水解程度,但其电离和水解程度都较小.
解答 解:A.小苏打是碳酸氢钠的俗称,溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故A错误;
B.醋酸钠溶液中醋酸根离子水解导致溶液呈碱性,结合电荷守恒得c(CH3COO-)<c(Na+),故B错误;
C.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒2得c(Na+)=c(CH3COO-)+c(CH3COOH),所以得c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),故C正确;
D.0.1mol/L的NaHA溶液呈酸性,说明HA-的电离程度大于水解程度,所以c(A2-)>c(H2A),但其电离和水解程度都较小,离子浓度大小顺序是c(HA-)>c(H+)>c(A2-)>c(H2A),故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确溶液中溶质成分及其性质是解本题关键,注意电荷守恒和物料守恒的灵活运用,注意D中要根据溶液酸碱性确定HA-的电离程度与水解程度关系,题目难度中等.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 钠在硫酸铁溶液中可置换出铁 | B. | 铜在硝酸银溶液中可置换出银 | ||
| C. | 铁不与H2O反应 | D. | 氢在空气中会自燃 |
19.下列有关实验装置,能达到实验目的是( )

| A. | 用图1所示装置制取少量Cl2 | B. | 用图2所示装置制取干燥的NH3 | ||
| C. | 用图3制备并检验H2的可燃性 | D. | 用图4装置鉴别碳酸钠和碳酸氢钠 |
16.25℃时,三种酸的电离平衡常数如表:
回答下列问题:
(1)一般情况下,当温度升高时,Ka增大(填“增大”、“减小”或“不变”).
(2)下列反应不能发生的是cd(填序号)
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-d.2ClO-+CO2+H2O=CO32-+2HClO
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验.资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
1写出步骤2中溶液变红色的离子方程式Fe3++3SCN-?Fe(SCN)3
2步骤3中现象a是出现白色沉淀
3用化学平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)一般情况下,当温度升高时,Ka增大(填“增大”、“减小”或“不变”).
(2)下列反应不能发生的是cd(填序号)
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-d.2ClO-+CO2+H2O=CO32-+2HClO
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验.资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
2步骤3中现象a是出现白色沉淀
3用化学平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
6.短周期主族元素Q、W、X、Y、Z原子序数依次增大,Q原子的最外层电子数是其内层电子总数的3倍,W是非金属性最强的元素,X的原子半径在短周期主族元素中为最大,Y是地壳中含量最多的金属元素,Z与Q同主族.下列叙述正确的是( )
| A. | 原子半径;r(Z)>r(W)>r(Q) | |
| B. | 气态氢化物的热稳定性:W>Q>Z | |
| C. | X与Z形成的化合物呈碱性的原因:Z2-+2H2O?H2Z+2OH- | |
| D. | Y与Z的二元化合物可以在溶液中通过复分解反应制得 |
11.某溶液中通人NO2仍能大量共存的离子是( )
| A. | Ag+、Na+、CO32- | B. | H+、Fe2+、Cl- | C. | Cu2+、H+、SO42- | D. | Ba2+、H+、SO42- |
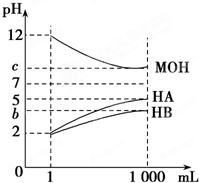 某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
 .
.