题目内容
3.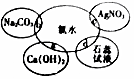 氯水具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(已知反应中氯水足量)
氯水具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(已知反应中氯水足量)(1)能证明氯水具有漂白性的现象是石蕊试剂先变红后褪色,c中产生的现象为生成白色沉淀.
(2)氯水中的Cl2与Ca(OH)2反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(3)久置的氯水会变为稀盐酸.
①写出该反应的化学方程式:Cl2+H2O=HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,.
②写出盐酸与Na2CO3反应产生无色无味的气体的离子方程式:CO32-+2H+=CO2↑+H2O.
分析 (1)氯水中含有盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,d过程所观察到的现象是先变红色,后褪色;c过程的反应是氯水中的盐酸和硝酸银反应得到氯化银沉淀,反应的化学方程式为:AgNO3+HCl=AgCl↓+HNO3;
(2)氯水中的Cl2与Ca(OH)2反应生成氯化钙和次氯酸钙,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)①氯气和水之间反应生成盐酸和次氯酸,根据离子方程式的书写原则来书写即可;
②碳酸钠和盐酸反应生成氯化钠、水以及二氧化碳.
解答 解:(1)氯水中含有盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,d过程所观察到的现象是先变红色,后褪色,所以氯水具有漂白性的现象是石蕊试剂先变红后褪色;c过程的反应是氯水中的盐酸和硝酸银反应得到氯化银沉淀,反应的化学方程式为:AgNO3+HCl=AgCl↓+HNO3,c中产生的现象为:生成白色沉淀,故答案为:石蕊试剂先变红后褪色;生成白色沉淀;
(2)氯水中的Cl2与Ca(OH)2反应生成氯化钙和次氯酸钙,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)①氯气和水之间反应生成盐酸和次氯酸,Cl2+H2O=HCl+HClO,次氯酸不稳定见光分解,反应方程式为:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,故答案为:Cl2+H2O=HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,
②碳酸钠和盐酸反应生成氯化钠、水以及二氧化碳,故答案为:CO32-+2H+=CO2↑+H2O.
点评 本题考查学生离子方程式的书写知识,注意知识的迁移应用是关键,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 金属锂作电池的负极 | |
| B. | 电池正极反应为FeS2+4Li++4e-═Fe+2Li2S | |
| C. | 放电时,Li+向负极迁移 | |
| D. | 电池总反应为FeS2+4Li═Fe+2Li2S |
| A. | 56g铁在足量氧气中燃烧,转移的电子数为2NA | |
| B. | 1g氢气含有NA个氢气分子 | |
| C. | 标准状况下,22.4 L水含有1 mol水分子 | |
| D. | 2 mol钠与过量稀盐酸反应生成NA个氢气分子 |
| A. | 钠在硫酸铁溶液中可置换出铁 | B. | 铜在硝酸银溶液中可置换出银 | ||
| C. | 铁不与H2O反应 | D. | 氢在空气中会自燃 |
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 0.1molAgCl和0.1molAgl混合后加入1 L水中,所得溶液中c(Cl-)>c(I-) | |
| D. | 25℃时,0.1mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
| A. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| B. | 氮元素的非金属性强于磷,氮气活泼性也强于磷 | |
| C. | 农村用明矾净化水,是利用其中Al (OH) 3胶体的吸附性 | |
| D. | NH4F溶液不能存放于玻璃试剂瓶中 |
| A. | 化学危险品易危害人类,应禁止生产 | |
| B. | 汽车尾气是目前城市大气污染产生的一个重要来源 | |
| C. | 氢氧化钠和氢氧化铝都可用于治疗胃酸过多 | |
| D. | 漂白粉长期放置在空气中不会变质 |
| A. | 原子半径;r(Z)>r(W)>r(Q) | |
| B. | 气态氢化物的热稳定性:W>Q>Z | |
| C. | X与Z形成的化合物呈碱性的原因:Z2-+2H2O?H2Z+2OH- | |
| D. | Y与Z的二元化合物可以在溶液中通过复分解反应制得 |