题目内容
19.表明金属甲的活动性比金属乙的活动性强的叙述正确的是( )| A. | 在氧化还原反应中,甲比乙失电子多 | |
| B. | 同价态阳离子,甲比乙的氧化性强 | |
| C. | 甲能与冷水反应而乙不能 | |
| D. | 将甲、乙组成原电池时,乙为负极 |
分析 A.金属的金属性强弱与失电子能力有关;
B.根据金属的金属性强弱与同价阳离子的关系分析;
C.金属水反应置换氢气越易,金属性越强;
D.原电池中金属性强的为负极.
解答 解:A.金属的金属性强弱与失电子多少无关,与失电子能力有关,如等物质的量的Al、Mg分别和足量稀盐酸反应,铝失电子多,但金属性Mg>Al,故A错误;
B.同价态的阳离子,甲比乙的氧化性强,则乙的金属性比甲的强,故B错误;
C.甲能与冷水反应而乙不能,则金属性甲大于乙,故C正确;
D.一般来说,原电池中较活泼金属作负极、较不活泼金属作正极,将甲、乙作电极组成原电池时,甲为正极,则金属性甲<乙,故D错误;
故选C.
点评 本题考查了金属活泼性的判断方法,要注意的是:金属的金属性强弱与得失电子的难易有关,与得失电子的多少无关,题目难度不大.

练习册系列答案
相关题目
10.对于工业合成氨反应:N2+3H2?2NH3,下列说法错误的是( )
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 无论如何增大H2浓度,都不能使N2转化率达到100% | |
| D. | 缩小体积,υ正增大,υ逆减小,平衡正向移动 |
11.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
| A. | 以X浓度变化表示的反应速率为0.0001mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H<0 |
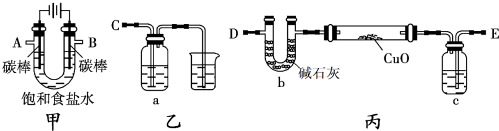
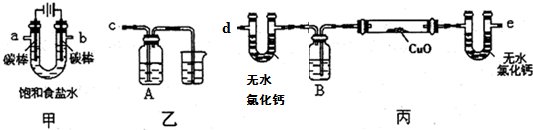
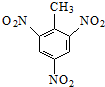 的系统命名:2,4,6-三硝基甲苯;
的系统命名:2,4,6-三硝基甲苯;