题目内容
17.下列分子中所有原子都满足最外层为8电子结构的是( )| A. | H2 | B. | CH4 | C. | HCl | D. | Cl2 |
分析 对ABn型分子,A的族序数+成键数=8,则满足所有原子都满足最外层8电子结构,含有H元素的化合物中H元素一定不满足8电子结构.
解答 解:A.H2中H原子最外层满足2电子结构,故A错误;
B.CH4分子中H原子最外层满足2电子结构,故B错误;
C.HCl分子中H原子最外层满足2电子结构,故C错误;
D.Cl2中,Cl原子的族序数+成键数=7+1=8,所以满足所有原子最外层为8电子结构,故D正确;
故选D.
点评 主要考查原子核外电子是否满足8电子稳定结构,题目难度不大,注意判断问题的角度.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
5.向有足量Na2O2的密闭容器中通入x mol CO和y mol H2的混合气体,再通入z mol O2,并用电火花使其充分反应,有关容器内反应的下列叙述不正确的是( )
| A. | 参加反应的Na2O2为(x+y)mol | |
| B. | 反应后容器内有O2 (x+y) mol | |
| C. | 反应前后容器内压强之比为(温度不变):(x+y+z)/z | |
| D. | 反应后生成了x mol Na2CO3 和2y mol NaOH |
12.在容积可变的密闭容器中,2mol N2和4mol H2在一定条件下发生反应,达到平衡时,H2的转化率为50%,则平衡时的氮气的体积分数接近于( )
| A. | 25% | B. | 28.6% | C. | 15% | D. | 20% |
2. 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1.
已知:H2O(l)=H2O(g)△H=+44kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-305.7kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如表:
①该反应是吸热反应(填“吸热”或“放热”);
②T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
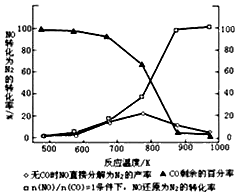
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图.
①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式CH4+2NO2=CO2+N2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池负极的电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O.
 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1.
已知:H2O(l)=H2O(g)△H=+44kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-305.7kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图.
①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式CH4+2NO2=CO2+N2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池负极的电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O.
7.常温下,下列各组微粒在指定溶液中可能大量共存的是( )
| A. | 0.1 mol/L FeCl3溶液:K+、Br-、H2O2 | |
| B. | 含大量NO3-的溶液:Fe2+、SO42-、H+ | |
| C. | 水电离产生的c(OH-)=10-13mol/L的溶液:Al3+、Na+、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:NH4+、CrO42-、ClO- |