题目内容
将稀硝酸逐滴加入盛有铝铁合金的容器中,当固体恰好完全溶解时,产生标准状况下NO 40.32L,将反应后的溶液平均分成三等份,分别进行如下实验:
(1)第一份溶液中逐滴加入2mol?L-1NaOH溶液,至恰好达到最大沉淀,不考虑空气中O2的氧化,则需加入NaOH溶液的体积为 .
(2)第二份溶液中边加入NaOH溶液,边在空气中充分搅拌,至恰好达到最大沉淀量,将产生的沉淀过滤、洗涤、干燥、称量比第一份重5.1g,则该过程中消耗O2的物质的量为 .
(3)第三份溶液中逐滴加入4mol?L-1NaOH溶液,至Al(OH)3沉淀恰好溶解,消耗NaOH溶液500mL,计算原合金中铝的质量.(写出解题过程)
(1)第一份溶液中逐滴加入2mol?L-1NaOH溶液,至恰好达到最大沉淀,不考虑空气中O2的氧化,则需加入NaOH溶液的体积为
(2)第二份溶液中边加入NaOH溶液,边在空气中充分搅拌,至恰好达到最大沉淀量,将产生的沉淀过滤、洗涤、干燥、称量比第一份重5.1g,则该过程中消耗O2的物质的量为
(3)第三份溶液中逐滴加入4mol?L-1NaOH溶液,至Al(OH)3沉淀恰好溶解,消耗NaOH溶液500mL,计算原合金中铝的质量.(写出解题过程)
考点:化学方程式的有关计算
专题:计算题
分析:滴加的硝酸与合金恰好完全反应,发生反应:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Al+4HNO3=Al(NO3)3+NO↑+2H2O,所得溶液为硝酸亚铁、硝酸铝溶液,将反应后的溶液平均分成三等份,每份溶液对应产生NO的体积为40.32L×
=13.44L,
(1)第一份溶液中逐滴加入2mol?L-1NaOH溶液,至恰好达到最大沉淀,不考虑空气中O2的氧化,此时溶液中溶质为NaNO3,由电荷守恒可知,金属提供电子物质的量等于NaOH物质的量,由每份溶液对应生成NO的体积,根据电子转移守恒计算金属提供电子物质的量,进而计算需要NaOH溶液的体积;
(2)与第一份所得沉淀相比增重5.1g,是由于发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,根据差量法计算参加反应氧气物质的量;
(3)第三份溶液中加入NaOH溶液,至Al(OH)3沉淀恰好溶解,此时溶液中溶质为NaAlO2、NaNO3,原溶液消耗NaOH为第三份溶液消耗氢氧化钠3倍,依据Na原子守恒有:n(NaOH)=n(NaAlO2)+n(NaNO3),由方程式可知n(HNO3)=4n(NO),根据N原子守恒计算n(NaNO3),再根据Al原子守恒n(Al)=n(NaAlO2)=n(NaOH)-n(NaNO3),再根据m=nM计算Al的质量.
| 1 |
| 3 |
(1)第一份溶液中逐滴加入2mol?L-1NaOH溶液,至恰好达到最大沉淀,不考虑空气中O2的氧化,此时溶液中溶质为NaNO3,由电荷守恒可知,金属提供电子物质的量等于NaOH物质的量,由每份溶液对应生成NO的体积,根据电子转移守恒计算金属提供电子物质的量,进而计算需要NaOH溶液的体积;
(2)与第一份所得沉淀相比增重5.1g,是由于发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,根据差量法计算参加反应氧气物质的量;
(3)第三份溶液中加入NaOH溶液,至Al(OH)3沉淀恰好溶解,此时溶液中溶质为NaAlO2、NaNO3,原溶液消耗NaOH为第三份溶液消耗氢氧化钠3倍,依据Na原子守恒有:n(NaOH)=n(NaAlO2)+n(NaNO3),由方程式可知n(HNO3)=4n(NO),根据N原子守恒计算n(NaNO3),再根据Al原子守恒n(Al)=n(NaAlO2)=n(NaOH)-n(NaNO3),再根据m=nM计算Al的质量.
解答:
解:滴加的硝酸与合金恰好完全反应,发生反应:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Al+4HNO3=Al(NO3)3+NO↑+2H2O,所得溶液为硝酸亚铁、硝酸铝溶液,将反应后的溶液平均分成三等份,每份溶液对应产生NO的体积为40.32L×
=13.44L,
(1)13.44L NO的物质的量=
=0.6mol,根据电子转移守恒,可知金属提供电子物质的量=0.6mol×(5-2)=1.8mol,第一份溶液中逐滴加入2mol?L-1NaOH溶液,至恰好达到最大沉淀,不考虑空气中O2的氧化,此时溶液中溶质为NaNO3,由电荷守恒可知,金属提供电子物质的量等于NaOH物质的量,即NaOH的物质的量为1.8mol,故需要NaOH溶液的体积=
=0.9L,
故答案为:0.9L;
(2)与第一份所得沉淀相比增重5.1g,是由于发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
令消耗氧气物质的量为xmol,则:
4Fe(OH)2+O2+2H2O=4Fe(OH)3 质量增重
1mol 4×17g
xmol 5.1g
1mol:xmol=4×17g:5.1g
解得x=0.075
故答案为:0.075mol;
(3)第三份溶液中加入NaOH溶液,至Al(OH)3沉淀恰好溶解,此时溶液中溶质为NaAlO2、NaNO3,原溶液消耗NaOH为第三份溶液消耗氢氧化钠3倍,故n(NaOH)=4mol/L×0.5L×3=6mol
依题意硝酸不过量,由方程式可知,n(HNO3)=4n(NO)=4×
=7.2mol,则,n(NaNO3)=7.2mol-×
=5.4mol,
依据Na原子守恒有:n(NaOH)=n(NaAlO2)+n(NaNO3),由Al元素守恒,n(Al)=n(NaAlO2)=n(NaOH)-n(NaNO3)=6mol-5.4mol=0.6mol,
故原合金中m(Al)=0.6mol×27g/mol=16.2g,
答:原合金中含铝的质量为16.2g.
| 1 |
| 3 |
(1)13.44L NO的物质的量=
| 13.44L |
| 22.4L/mol |
| 1.8mol |
| 2mol/L |
故答案为:0.9L;
(2)与第一份所得沉淀相比增重5.1g,是由于发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
令消耗氧气物质的量为xmol,则:
4Fe(OH)2+O2+2H2O=4Fe(OH)3 质量增重
1mol 4×17g
xmol 5.1g
1mol:xmol=4×17g:5.1g
解得x=0.075
故答案为:0.075mol;
(3)第三份溶液中加入NaOH溶液,至Al(OH)3沉淀恰好溶解,此时溶液中溶质为NaAlO2、NaNO3,原溶液消耗NaOH为第三份溶液消耗氢氧化钠3倍,故n(NaOH)=4mol/L×0.5L×3=6mol
依题意硝酸不过量,由方程式可知,n(HNO3)=4n(NO)=4×
| 40.32L |
| 22.4L/mol |
| 40.32L |
| 22.4L/mol |
依据Na原子守恒有:n(NaOH)=n(NaAlO2)+n(NaNO3),由Al元素守恒,n(Al)=n(NaAlO2)=n(NaOH)-n(NaNO3)=6mol-5.4mol=0.6mol,
故原合金中m(Al)=0.6mol×27g/mol=16.2g,
答:原合金中含铝的质量为16.2g.
点评:本题考查混合物计算、化学方程式的有关计算,清楚发生的反应是关键,注意利用守恒法进行的解答,(3)为易错点、难点,学生容易计算成每份溶液对应Al的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的反应速率为0.1mol/(L?min),则此段时间内以C的浓度变化表示的化学反应速率为( )
| A、0.5 mol/(L?min) |
| B、0.1 mol/(L?min) |
| C、0.2 mol/(L?min) |
| D、0.3 mol/(L?min) |
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有( )试剂的洗气瓶.
| A、澄清石灰水,浓H2SO4 |
| B、KMnO4酸性溶液,浓H2SO4 |
| C、浓H2SO4,KMnO4酸性溶液 |
| D、溴水,烧碱溶液,浓硫酸 |
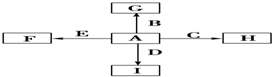
 A、B、C、D是中学化学常见的四种物质,它们的转化关系如下:A+B=C+D
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下:A+B=C+D 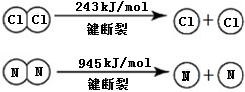 断开1mol H-N键与断开1mol H-Cl键所需能量相差约为
断开1mol H-N键与断开1mol H-Cl键所需能量相差约为 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表: 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: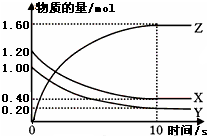 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则