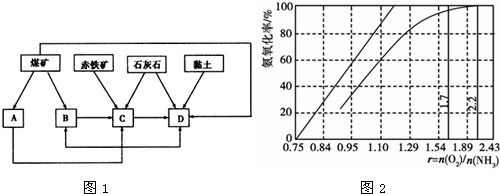
题目内容
9.25℃时,由水电离出c(OH-)=1×10-11mol/L 的溶液中,一定能大量共存的离子组是( )| A. | Al3+、NH4+、Cl-、CO32- | B. | Na+、CH3COO-、K+、HCO3- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | K+、I-、Cl-、Rb+ |
分析 若溶液中由水电离产生的c(OH-)=1×10-11mol•L-1<10-7mol•L-1,说明该溶液呈酸性或碱性,如果能共存,则这几种离子和氢离子或氢氧根离子之间不反应,以此解答该题.
解答 解:溶液中由水电离产生的c(OH-)=1×10-11mol•L-1<10-7mol•L-1,说明该溶液呈酸性或碱性,
A.碱性条件下Al3+、NH4+发生反应,不能大量共存,故A错误;
B.酸性条件下CH3COO-、HCO3-不能大量共存,故B错误;
C.酸性条件下Fe2+和NO3-发生氧化还原反应,碱性条件下Fe2+反应生成沉淀,不能大量共存,故C错误;
D.这几种离子之间不反应,且这几种离子和氢离子或氢氧根离子都不反应,所以满足此条件的溶液中一定能大量共存,故D正确.
故选D.
点评 本题考查了离子共存,根据水的电离程度确定溶液酸碱性,再结合离子共存条件来分析解答,易错选项是C,注意:酸性条件下亚铁离子和硝酸根离子能发生反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,为易错点.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
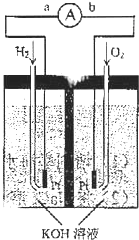 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
 ;
;