题目内容
13.将过量的铁粉投入到盛有硫酸铜和稀硫酸的混合溶液中,充分反应后,过滤,滤液中含有物质是( )| A. | 硫酸铁 | B. | 硫酸铜 | C. | 硫酸 | D. | 硫酸亚铁 |
分析 铁与硫酸反应生成硫酸亚铁和氢气,与硫酸铜反应生成硫酸亚铁和铜,以此解答.
解答 解:金属活动顺序表中,前边的金属可以把后边的金属从其盐溶液中置换出来,铁、铜三种金属的活动性强弱是:铁>氢>铜,所以在硫酸铜和稀硫酸混合溶液中,加入过量的铁粉,铁会和硫酸铜溶液反应,把铜置换出来,和稀硫酸反应产生硫酸亚铁和氢气,滤液中只含有硫酸亚铁.
故选D.
点评 本题考查铁和硫酸铜的反应、铁和硫酸的反应,是对金属的化学性质的综合考查,而且要注意单质铁与硫酸、硫酸铜反应后生成的是硫酸亚铁而不是硫酸铁.

练习册系列答案
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
3.下列说法错误的是( )
| A. | 鉴别Na2CO3和NaHCO3可用Ba(OH)2或Ca(OH)2溶液 | |
| B. | 除去Na2CO3固体中混有的少量NaHCO3,可采用加热法 | |
| C. | CO2中混有少量HCl、SO2等气体时,可用饱和NaHCO3溶液提纯气体 | |
| D. | 将澄清石灰水滴入NaHCO3溶液中,开始时发生反应的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
4.下列离子反应方程式正确的是( )
| A. | 碳酸氢钠溶液跟过量的饱和石灰水反应 HCO3-+Ca2++OH-═CaCO3↓+2H2O | |
| B. | 向NaHSO4溶液中滴加Ba(OH)2溶液显中性H++SO42-+-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氯化亚铁溶液中通入氯气 Fe2++Cl2═Fe3++2Cl- | |
| D. | 苛性钾溶液中加入稀盐酸 H++OH-═H2O |
1.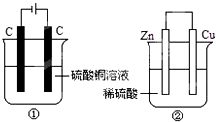 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阳极:4OH --4e -═2H2O+O2↑ ②中负极:2H ++2e -═H2↑ | |
| D. | 溶液的pH变化:①减小,②增大 |
8.下列除杂质的操作中不正确的是( )
| A. | Na2CO3 固体中混有少量NaHCO3:加热固体至质量恒定 | |
| B. | NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 | |
| C. | CO2中混有HCl:将其通过装NaOH溶液的洗气瓶 | |
| D. | NaCl溶液中混有少量I2:加入适量CCl4,振荡,静置,分液 |
2. 如图
如图  为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )
 如图
如图  为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )| A. | a为直流电源的负极 | B. | c极发生的反应为2H++2e═-H2↑ | ||
| C. | f电极为锌板 | D. | e极发生还原反应 |
3.下列说法中不正确的是(NA代表阿伏加德罗常数的值)( )
| A. | 13C与14C属于同一种元素,它们互为同位素 | |
| B. | 28g乙烯和氮气的混合气体中含有NA个气体分子 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀 | |
| D. | 常温下,1mol•L-1的 Na2CO3溶液中阴离子总数大于2NA |
 .
. A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)