题目内容
物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
| A、Ba(OH)2、Na2SO3、FeCl3、KCl |
| B、Na2CO3、NaHCO3、KNO3、NH4Cl |
| C、NH3?H2O、H3PO4、Na2SO4、H2SO4 |
| D、HCl、CH3COOH、C2H5OH、Na2SiO3 |
考点:盐类水解的应用
专题:盐类的水解专题
分析:根据碱溶液的pH>盐溶液的pH>酸溶液的pH,及盐溶液中强酸弱碱盐水解显酸性、强碱弱酸盐水解显碱性、不水解的盐显中性、盐中有弱才水解、越弱越水解等来解答.
解答:
解:A、Ba(OH)2为强碱,溶液呈强碱性,pH远大于7;Na2SO3为强碱弱酸盐,水解呈弱碱性,pH大于7,FeCl3是强酸弱碱盐,水解溶液呈酸性,pH小于7,KCl是强碱强酸盐溶液呈中性,pH等于7,则不是按照pH由大到小排列,故A错误;
B、Na2CO3水解显碱性,Na2CO3水解程度大于NaHCO3,等浓度时a2CO3的pH较大,KNO3不水解为中性,NH4Cl水解显酸性,则pH由大到小排列为Na2CO3、NaHCO3、KNO3、NH4Cl,故B正确;
C、NH3?H2O为弱碱,pH值最大,H3PO4显酸性,pH小于7,Na2SO4呈中性,pH等于7,硫酸为强酸,其pH远小于7,则不是按照pH由大到小排列,故C错误;
D、Na2SiO3水解显碱性,其pH大于7,C2H5OH呈中性,CH3COOH为弱酸呈酸性,HCl为强酸,其pH远小于7,则不是按照pH由大到小排列,故D错误;
故选B.
B、Na2CO3水解显碱性,Na2CO3水解程度大于NaHCO3,等浓度时a2CO3的pH较大,KNO3不水解为中性,NH4Cl水解显酸性,则pH由大到小排列为Na2CO3、NaHCO3、KNO3、NH4Cl,故B正确;
C、NH3?H2O为弱碱,pH值最大,H3PO4显酸性,pH小于7,Na2SO4呈中性,pH等于7,硫酸为强酸,其pH远小于7,则不是按照pH由大到小排列,故C错误;
D、Na2SiO3水解显碱性,其pH大于7,C2H5OH呈中性,CH3COOH为弱酸呈酸性,HCl为强酸,其pH远小于7,则不是按照pH由大到小排列,故D错误;
故选B.
点评:本题考查溶液的酸碱性,熟悉盐类水解的规律:谁弱谁水解,谁强显谁性等来判断盐类水解后溶液的酸碱性是解答本题的关键,难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
用下列实验装置进行相应实验,能达到实验目的是( )
A、 验证Na和水反应放热 |
B、 将溶液定容到100mL |
C、 分离酒精和水 |
D、 检查装置的气密性 |
加热条件下,将24g CuO、Fe2O3的混合物与充足的CO完全反应,并将反应后的气体全部通入到澄清石灰水中,得到白色沉淀40g.下列有关叙述中正确的是( )
| A、原混合物中CuO与Fe2O3物质的量的比为l:l |
| B、反应后所得CO2的质量为8.8g |
| C、参加反应的CO的质量为8.4g |
| D、原混合物中CuO与Fe2O3的质量比为1:1 |
用下列实验装置进行的实验中,不能达到相应实验目的是( )
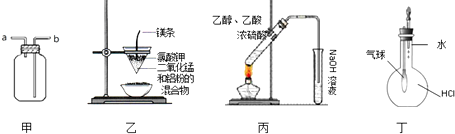

| A、装置甲:气体从a口进入,收集NH3 |
| B、装置乙:可制得金属锰 |
| C、装置丙:实验室制取乙酸乙酯 |
| D、装置丁:验证HCl气体在水中的溶解性 |
“封管实验”具有简易、方便、节约、绿色等优点.观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )


| A、加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B、加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色固体 |
| C、加热时,c中溶液红色变深,冷却后又逐渐变浅 |
| D、水浴时,d内气体颜色加深,e内气体颜色变浅 |
物质的量浓度、体积都相同的一元酸和一元碱恰好中和时,溶液将( )
| A、显酸性 | B、显中性 |
| C、显碱性 | D、无法确定酸碱性 |
下列离子方程式正确的是( )
| A、NaHSO4与过量的Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+OH-=CO32-+H2O |
| C、碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑ |
| D、硫化钠溶于水中:S2-+2H2O=H2S↑+2OH- |