题目内容
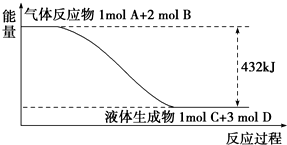 某反应过程中的能量变化如图所示:
某反应过程中的能量变化如图所示:(1)写出该反应的热化学方程式:
(2)在溶液中进行化学反应中的物质,其状态标为“aq”,已知0.5mol H2SO4在溶液中与足量氢氧化钠反应放出57.3kJ的热量,用离子方程式写出该反应的热化学方程式:
(3)合成氨反应的热化学方程式:
N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1
已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2kJ的热量,至少在反应混合物中要投放N2的物质的量为
考点:反应热和焓变
专题:化学反应中的能量变化
分析:(1)图示所指反应是放热反应,注意各物质的状态;
(2)注意溶液的状态符号以及中和反应的实质;
(3)热化学方程式中的△H是指反应物完全转化时的△H.
(2)注意溶液的状态符号以及中和反应的实质;
(3)热化学方程式中的△H是指反应物完全转化时的△H.
解答:
解:(1)从图上可见,反应放热,△H<0,注意各物质的状态,该反应的热化学方程式为A(g)+2B(g)═C(l)+3D(l)△H=-432 kJ?mol-1,
故答案为:A(g)+2B(g)═C(l)+3D(l)△H=-432 kJ?mol-1;
(2)0.5mol H2SO4在溶液中与足量氢氧化钠反应,实质上是1molH+与OH-的中和反应,热化学方程式为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,
故答案为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1;
(3)在N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1反应中的△H是指1molN2(g)与3nolH2(g)完全转化为2mol2NH3(g)时放出的热量,要想通过该反应得到92.2kJ的热量,需要1molN2(g)参加反应,若2的转化率为10%,需加入的N2(g)的物质的量为
=10mol,故答案为:10.
故答案为:A(g)+2B(g)═C(l)+3D(l)△H=-432 kJ?mol-1;
(2)0.5mol H2SO4在溶液中与足量氢氧化钠反应,实质上是1molH+与OH-的中和反应,热化学方程式为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,
故答案为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1;
(3)在N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1反应中的△H是指1molN2(g)与3nolH2(g)完全转化为2mol2NH3(g)时放出的热量,要想通过该反应得到92.2kJ的热量,需要1molN2(g)参加反应,若2的转化率为10%,需加入的N2(g)的物质的量为
| 1mol |
| 0.1 |
点评:本题考查反应热与能量变化,侧重于考查学生的分析能力和自学能力,题目难度不大,注意把握题给信息,答题时注意仔细审题.

练习册系列答案
相关题目
下列叙述中错误的是( )
| A、2mol NO和2mol NO2含原子数不同 |
| B、等质量的O2和O3中所含氧原子个数相同 |
| C、等物质的量的CO和CO2中所含碳原子数相等 |
| D、H2SO4的摩尔质量是98 |
下列关于氧化物的叙述正确的是( )
| A、能和强酸溶液反应的氧化物就是碱性氧化物 |
| B、不能跟碱反应的氧化物一定能和酸反应 |
| C、金属氧化物一定是碱性氧化物 |
| D、酸性氧化物不一定都能与水反应生成酸 |
