题目内容
标准状况下,把44.8L HCl气体溶于水配成100mL 溶液,求:
(1)所得溶液的物质的量浓度是多少?
(2)写出锌与该溶液反应的化学方程式
(3)取该盐酸溶液10mL,加水稀释至100mL,求稀释后所得溶液的物质的量浓度.
(1)所得溶液的物质的量浓度是多少?
(2)写出锌与该溶液反应的化学方程式
(3)取该盐酸溶液10mL,加水稀释至100mL,求稀释后所得溶液的物质的量浓度.
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:n(HCl)=
=2mol,
(1)根据C=
计算溶液的物质的量浓度;
(2)锌和稀盐酸反应生成氯化锌和氢气;
(3)稀释前后氯化氢的物质的量不变,据此计算.
| 44.8L |
| 22.4L/mol |
(1)根据C=
| n |
| V |
(2)锌和稀盐酸反应生成氯化锌和氢气;
(3)稀释前后氯化氢的物质的量不变,据此计算.
解答:
解:n(HCl)=
=2mol,
(1)C=
=
=20mol/L,
答:所得溶液的物质的量浓度是20mol/L;
(2)锌和稀盐酸反应生成氯化锌和氢气,反应方程式为Zn+2HCl=ZnCl2+H2↑,答:该反应的方程式为Zn+2HCl=ZnCl2+H2↑;
(3)稀释前后氯化氢的物质的量不变,则稀释后溶液的物质的量浓度=
=2mol/L,
答:稀释后所得溶液的物质的量浓度是2mol/L.
| 44.8L |
| 22.4L/mol |
(1)C=
| n |
| V |
| 2mol |
| 0.1L |
答:所得溶液的物质的量浓度是20mol/L;
(2)锌和稀盐酸反应生成氯化锌和氢气,反应方程式为Zn+2HCl=ZnCl2+H2↑,答:该反应的方程式为Zn+2HCl=ZnCl2+H2↑;
(3)稀释前后氯化氢的物质的量不变,则稀释后溶液的物质的量浓度=
| 20mol/L×0.01L |
| 0.1L |
答:稀释后所得溶液的物质的量浓度是2mol/L.
点评:本题考查了物质的量浓度的有关计算,根据C=
及溶液稀释特点来分析解答,题目难度不大.
| n |
| V |

练习册系列答案
相关题目
下列制备物质的实验能够成功的是( )
| A、将NaF溶液与浓硫酸混合共热制取氟化氢气体 | ||||
B、工业上:H2+Cl2
| ||||
| C、实验室用浓磷酸与溴化钠共热制溴化氢气体 | ||||
| D、实验室用碘化钠与浓硫酸共热制碘化氢气体 |
人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e=ZnO+H2↑,Ag2O+H2O+2e═2Ag+2OH-.据此判断锌是( )
| A、负极,并被氧化 |
| B、正极,并被还原 |
| C、负极,并被还原 |
| D、正极,并被氧化 |
下列各微粒中,核外电子总数相等的是( )
| A、Na和Na+ |
| B、N2和 CO2 |
| C、NH4+和 H2O |
| D、H2S 和 H2O |
下列过程能使蛋白质变性的是K( )
| A、蛋白质中加Na2SO4后析出蛋白质 |
| B、蛋白质用福尔马林浸泡 |
| C、蛋白质中加Pb(Ac)2后析出蛋白质固体 |
| D、蛋白质中遇X光后 |
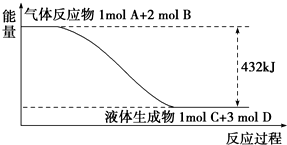 某反应过程中的能量变化如图所示:
某反应过程中的能量变化如图所示: