题目内容
一定温度下,密闭容器中M、N、R三种气体的初始浓度和平衡浓度如下表所示:
(1)请通过计算写出此反应的化学方程式.
(2)达平衡时,N的转化率是多少?
(3)该温度下的平衡常数.
| 物质 | M | N | R |
| 初始浓度/mol?L-1 | 0.20 | 0.30 | 0 |
| 平衡浓度/mol?L-1 | 0.02 | 0.21 | 0.18 |
(2)达平衡时,N的转化率是多少?
(3)该温度下的平衡常数.
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)M、N的浓度减小,为反应物,R的浓度增大为生成物,由于M、N的浓度最终保存不变,且不为0,该反应为可逆反应,利用浓度之比等于化学计量数之比确定各物质的化学计量数,据此书写;
(2)N的转化率=
×100%;
(3)依据平衡浓度和平衡常数概念计算,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(2)N的转化率=
| 消耗量 |
| 起始量 |
(3)依据平衡浓度和平衡常数概念计算,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
解答:
解:(1)M、N的浓度减小,为反应物,R的浓度增大为生成物,由于M、N的浓度最终保存不变,且不为0,该反应为可逆反应,
M的浓度变化量为:(0.2-0.02)mol/L=0.18mol/L,
N的浓度变化量为:(0.3-0.21)mol/L=0.09mol/L,
R的浓度变化量为:0.18mol/L,
故M、N、R的化学计量数之比=0.18:0.09:0.18=2:1:2,
故反应方程式为:2M+N?2R,
答:该反应化学方程式为2M+N?2R;
(2)N的转化率=
×100%=
×100%=30%,
答:N的转化率为30%;
(3)2M+N?2R,平衡浓度c(M)=0.02mol/L,c(N)=0.21mol/L,c(R)=0.18mol/L,
K=
=385.7L﹒mol-1;
答:该温度下的平衡常数385.7L﹒mol-1.
M的浓度变化量为:(0.2-0.02)mol/L=0.18mol/L,
N的浓度变化量为:(0.3-0.21)mol/L=0.09mol/L,
R的浓度变化量为:0.18mol/L,
故M、N、R的化学计量数之比=0.18:0.09:0.18=2:1:2,
故反应方程式为:2M+N?2R,
答:该反应化学方程式为2M+N?2R;
(2)N的转化率=
| 消耗量 |
| 起始量 |
| 0.09mol/L |
| 0.3mol/L |
答:N的转化率为30%;
(3)2M+N?2R,平衡浓度c(M)=0.02mol/L,c(N)=0.21mol/L,c(R)=0.18mol/L,
K=
| (0.18mol/L)2 |
| (0.02mol/L)2×0.21mol/L |
答:该温度下的平衡常数385.7L﹒mol-1.
点评:本题考查化学平衡有关计算,主要是化学方程式书写方法,平衡常数、转化率概念的计算应用,比较基础,注意对基础知识的掌握.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
在下列各溶液中,离子一定能大量共存的是( )
| A、强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SiO32- |
| C、AlO2-浓度为0.1 mol?L-1的溶液中:Na+、K+、HCO3-、Cl- |
| D、H+浓度为1×10-13mol?L-1的溶液中,Na+、K+、Cl-、NO2- |
下列过程能使蛋白质变性的是K( )
| A、蛋白质中加Na2SO4后析出蛋白质 |
| B、蛋白质用福尔马林浸泡 |
| C、蛋白质中加Pb(Ac)2后析出蛋白质固体 |
| D、蛋白质中遇X光后 |
分类是化学研究中常用的方法.下列分类方法中,不正确的是( )
| A、依据分子中含有的氢原子的数目,将酸分为一元酸、二元酸等 |
| B、依据在水溶液里或熔融状态下能否导电,将化合物分为电解质和非电解质 |
| C、依据分散质粒子直径的大小,将分散系分为溶液、胶体、浊液 |
| D、依据组成元素的种类,将纯净物分为单质和化合物 |
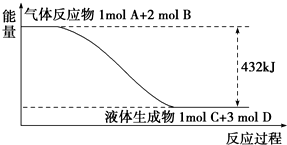 某反应过程中的能量变化如图所示:
某反应过程中的能量变化如图所示: