题目内容
下列叙述中错误的是( )
| A、2mol NO和2mol NO2含原子数不同 |
| B、等质量的O2和O3中所含氧原子个数相同 |
| C、等物质的量的CO和CO2中所含碳原子数相等 |
| D、H2SO4的摩尔质量是98 |
考点:物质分子中的原子个数计算,摩尔质量
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.根据1个NO和NO2中所含原子数分别为2、3;
B.根据n=
=
结合分子的构成解答;
C.根据1个CO和CO2中所含碳原子数都为1;
D.摩尔质量的单位是g/mol.
B.根据n=
| m |
| M |
| N |
| NA |
C.根据1个CO和CO2中所含碳原子数都为1;
D.摩尔质量的单位是g/mol.
解答:
解:A.2mol NO和2mol NO2含原子数分别为4mol,6mol,故A正确;
B.设质量都为mg,等质量的氧气(O2)和臭氧(O3),物质的量之比为
:
=3:2,则氧原子个数为3NA×2:2NA×3=1:1,故B正确;
C.1个CO和CO2中所含碳原子数都为1,等物质的量的CO和CO2中所含碳原子数相等,故C正确;
D.H2SO4的摩尔质量是98g/mol,故D错误;
故选D.
B.设质量都为mg,等质量的氧气(O2)和臭氧(O3),物质的量之比为
| m |
| 32 |
| m |
| 48 |
C.1个CO和CO2中所含碳原子数都为1,等物质的量的CO和CO2中所含碳原子数相等,故C正确;
D.H2SO4的摩尔质量是98g/mol,故D错误;
故选D.
点评:本题主要考查学生对化学用语的理解、微粒数目的计算等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、AlCl3溶液与过量的氨水反应:Al3++3OH-=Al(OH)3↓ |
| B、工业上用NO2与水反应制取HNO3:3NO2+H2O═NO3-+NO+2H+ |
| C、碳酸氢钠溶液与稀硫酸反应:HCO3-+H+=CO2↑+H2O |
| D、硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
下列制备物质的实验能够成功的是( )
| A、将NaF溶液与浓硫酸混合共热制取氟化氢气体 | ||||
B、工业上:H2+Cl2
| ||||
| C、实验室用浓磷酸与溴化钠共热制溴化氢气体 | ||||
| D、实验室用碘化钠与浓硫酸共热制碘化氢气体 |
以下离子方程式书写错误的是( )
①铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
②硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO
═BaSO4↓
③碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑
④氢氧化铜中加入盐酸:OH-+H+═H2O.
①铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
②硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO
2- 4 |
③碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑
④氢氧化铜中加入盐酸:OH-+H+═H2O.
| A、①②④ | B、①③ | C、全部 | D、①④ |
在下列各溶液中,离子一定能大量共存的是( )
| A、强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SiO32- |
| C、AlO2-浓度为0.1 mol?L-1的溶液中:Na+、K+、HCO3-、Cl- |
| D、H+浓度为1×10-13mol?L-1的溶液中,Na+、K+、Cl-、NO2- |
能正确解释下列反应原理的离子方程式是( )
| A、用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+ |
| B、用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O |
| C、用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu=Fe2++Cu2+ |
| D、FeCl3溶液中撒入CaCO3粉末有气泡产生:2Fe3++3CaCO3+3H2O=2Fe(OH)3↓+3Ca2++3CO2↑ |
人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e=ZnO+H2↑,Ag2O+H2O+2e═2Ag+2OH-.据此判断锌是( )
| A、负极,并被氧化 |
| B、正极,并被还原 |
| C、负极,并被还原 |
| D、正极,并被氧化 |
下列各微粒中,核外电子总数相等的是( )
| A、Na和Na+ |
| B、N2和 CO2 |
| C、NH4+和 H2O |
| D、H2S 和 H2O |
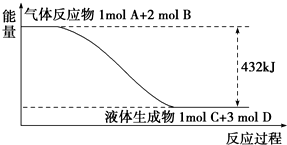 某反应过程中的能量变化如图所示:
某反应过程中的能量变化如图所示: