题目内容
将4mol A气体和2mol B气体在2L的密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)?2C(g)若经过2秒后测得C的浓度为0.6mol/L.则:
(1)2s内用B表示的反应速率
(2)2s时A的物质的量浓度为
(3)2s时B的物质的量为
(4)最终C的浓度 (填“能”或“不能”)达到2mol/L.
(1)2s内用B表示的反应速率
(2)2s时A的物质的量浓度为
(3)2s时B的物质的量为
(4)最终C的浓度
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡三段式列式计算,若经过2秒后测得C的浓度为0.6mol/L.生成C物质的量=0.6mol/L×2L=1.2mol
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s量(mol) 2.8 1.4 1.2
据此分析计算;
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s量(mol) 2.8 1.4 1.2
据此分析计算;
解答:
解:依据化学平衡三段式列式计算,若经过2秒后测得C的浓度为0.6mol/L.生成C物质的量=0.6mol/L×2L=1.2mol,
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
平衡量(mol) 2.8 1.4 1.2
(1)2s内用B表示的反应速率=
=0.15 mol/(L?s);
故答案为:0.15 mol/(L?s);
(2)2s时A的物质的量浓度=
=1.4mol/L;
故答案为:1.4mol/L;
(3)计算可知2s时B的物质的量为1.4mol;
故答案为:1.4mol;
(4)最终C的浓度若为2mol/L,需要4molA全部反应生成C4mol,但最后达到平衡状态是可逆反应,不能进行彻底,所以不能达到2mol/L;
故答案为:不能;
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
平衡量(mol) 2.8 1.4 1.2
(1)2s内用B表示的反应速率=
| ||
| 2s |
故答案为:0.15 mol/(L?s);
(2)2s时A的物质的量浓度=
| 2.8mol |
| 2L |
故答案为:1.4mol/L;
(3)计算可知2s时B的物质的量为1.4mol;
故答案为:1.4mol;
(4)最终C的浓度若为2mol/L,需要4molA全部反应生成C4mol,但最后达到平衡状态是可逆反应,不能进行彻底,所以不能达到2mol/L;
故答案为:不能;
点评:本题考查了化学平衡计算分析方法,影响平衡因素分析判断,速率、浓度计算,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
以下离子方程式书写错误的是( )
①铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
②硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO
═BaSO4↓
③碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑
④氢氧化铜中加入盐酸:OH-+H+═H2O.
①铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
②硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO
2- 4 |
③碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑
④氢氧化铜中加入盐酸:OH-+H+═H2O.
| A、①②④ | B、①③ | C、全部 | D、①④ |
下列各微粒中,核外电子总数相等的是( )
| A、Na和Na+ |
| B、N2和 CO2 |
| C、NH4+和 H2O |
| D、H2S 和 H2O |
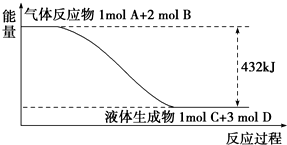 某反应过程中的能量变化如图所示:
某反应过程中的能量变化如图所示: