题目内容
17.某实验小组依据反应AsO43-+2H++2I-?AsO33-+I2+H2O设计如图1原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图2.下列有关叙述错误的是( )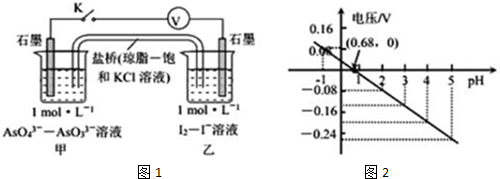
| A. | pH>0.68时,甲烧杯中石墨为负极 | |
| B. | pH=0.68时,反应处于平衡状态 | |
| C. | pH<0.68时,氧化性I2<AsO43- | |
| D. | pH=5时,负极电极反应式为2I--2e-=I2 |
分析 A.pH>0.68时,电压小于0,反应向左进行,AsO33-失电子,甲烧杯中石墨为负极;
B.pH=0.68时,电压为0,反应处于平衡状态;
C.pH<0.68时,电压大于0,反应向右进行,AsO43-为氧化剂,I2为氧化产物,氧化性:氧化剂>氧化产物;
D.pH=5时,反应向左进行,负极反应为AsO33-失电子.
解答 解:A.pH>0.68时,电压小于0,反应向左进行,AsO33-失电子,甲烧杯中石墨为负极,故A正确;
B.pH=0.68时,电压为0,反应处于平衡状态,故B正确;
C.pH<0.68时,电压大于0,反应向右进行,AsO43-为氧化剂,I2为氧化产物,氧化性 AsO43->I2,故C正确;
D.pH=5时,反应向左进行,负极反应为AsO33-失电子,故D错误.
故选:D.
点评 本题考查了原电池原理的应用和化学平衡移动,侧重于知识的综合应用的考查,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列实验方案不能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| D | 验证苯和液溴在FeBr3的催化下发生取代反应 | 将反应产生的混合气体先通入溴的四氯化碳溶液再通入AgNO3溶液中,观察是否有淡黄色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
12.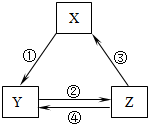 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Fe2O3 | FeCl3 | Fe(OH)3 | ③加入盐酸 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加入盐酸 |
| A. | A | B. | B | C. | C | D. | D |
12.用下列实验装置进行相应实验,装置正确且能达到实验目的是( )


| A. | 用图a所示装置干燥NH3气体 | |
| B. | 用图b所示装置蒸发NaCl溶液得NaCl晶体 | |
| C. | 用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 用图d所示装置测量氯气的体积 |
9.室温下,将下列气体通入到相应0.10 mol•L-1的溶液至pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系不正确的是( )
| A. | HCl→CH3COONa溶液:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | CO2→NH4HCO3溶液:c(NH4+)═c(HCO3-)+2c(CO32-) | |
| C. | SO2→NaOH溶液:c(Na+)═c(SO32-)+c(HSO3-)+c(H2SO3) | |
| D. | Cl2→NaOH溶液:2c(Cl-)═c(Na+)+c(HClO) |
6.下列说法不正确的是( )
| A. | 金刚石和石墨互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| D. | 分子式为C4H10的物质为纯净物 |
7.已知热化学方程式:
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ/mol
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
据此判断下列说法正确的是( )
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ/mol
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
据此判断下列说法正确的是( )
| A. | CH3OH的燃烧热为1452kJ/mol | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H>-571.6kJ/mol | |
| C. | 2CH3OH(l)+O2(g)═2CO2(g)+4H2(g)△H=-880.4kJ/mol | |
| D. | CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H=-57.3kJ/mol |
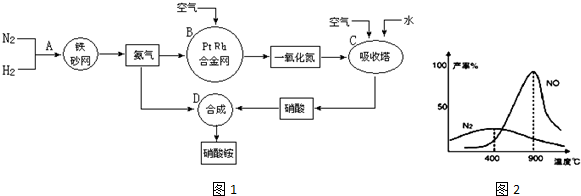
 4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.
4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.