题目内容
9.已知常温下Ksp(AgCl)=1.6×10-10、Ksp(AgI)=2.0×10-16,下列说法中正确的是( )| A. | 含有大量Cl-的溶液中肯定不存在Ag+ | |
| B. | AgI悬浊液中加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小 | |
| C. | AgCl悬浊液中逐渐加入KI固体至c(I-)=$\frac{{K}_{sp}(AgI)}{{K}_{sp}(AgCl)}$mol•L-1时,AgCl开始向AgI沉淀转化 | |
| D. | 向浓度均为0.01 mol•L-1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl-开始沉淀时,溶液中I-的浓度为1.25×10-8 mol•L-1 |
分析 A.一般认为离子浓度为10-5mol•L-1时沉淀完全;
B.加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I-(aq)向左移动,c(I-)浓度增大,c(Ag+)减小,但引入K+;
C.发生AgCl(s)+I-(aq)?AgI(s)+Cl-(aq),K=$\frac{{K}_{sp}(AgCl)}{{K}_{sp}(AgI)}$;
D.当Cl-开始沉淀时,c(Ag+)=$\frac{1.6×1{0}^{-10}}{0.01}$=1.6×10-8mol/L,溶液中I-的浓度为$\frac{2.0×1{0}^{-16}}{1.6×1{0}^{-8}}$.
解答 解:A.一般认为离子浓度为10-5mol•L-1时沉淀完全,则含有大量Cl-的溶液中,肯定存在少量的Ag+,故A错误;
B.加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I-(aq)向左移动,c(I-)浓度增大,c(Ag+)减小,但引入K+,则离子的总浓度会增大,故B错误;
C.发生AgCl(s)+I-(aq)?AgI(s)+Cl-(aq),K=$\frac{{K}_{sp}(AgCl)}{{K}_{sp}(AgI)}$,则$\frac{c(C{l}^{-})}{c({I}^{-})}$<$\frac{{K}_{sp}(AgCl)}{{K}_{sp}(AgI)}$时正向移动,即c(I-)=$\frac{{K}_{sp}(AgI)}{{\sqrt{Ksp(AgCl)}}_{\;}}$mol•L-1时,AgCl开始向AgI沉淀转化,故C错误;
D.当Cl-开始沉淀时,c(Ag+)=$\frac{1.6×1{0}^{-10}}{0.01}$=1.6×10-8mol/L,溶液中I-的浓度为$\frac{2.0×1{0}^{-16}}{1.6×1{0}^{-8}}$=1.25×10-8 mol•L-1,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算、溶解平衡移动、沉淀转化为解答的关键,侧重分析与应用能力的考查,注意K的计算,题目难度不大.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案| A. | 平均反应速度:乙>甲 | B. | 平衡时nc(甲)>nc(乙) | ||
| C. | 平衡时C的转化率:甲>乙 | D. | 平衡时A的物质的量甲>乙 |
①单质;②混合物;③化合物;④纯净物;⑤氧化物.
| A. | ①②③ | B. | ②③④⑤ | C. | ①③⑤ | D. | ③④⑤ |
 25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )
25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )| A. | Ag2CO3的Ksp为8.1×10-12 | |
| B. | Ag2CO3(s)+2Cl-(aq)?2AgCl(s)+CO32-(aq)平衡常数K=2.5×108 | |
| C. | 在Ag2CO3的饱和溶液中加入K2CO3(s)可使c(CO32-)增大(由Y点到Z点) | |
| D. | 在0.001mol•L-1AgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀 |
①2H2(g)+CO(g)?CH3OH (g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
(1)总合成反应的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol.
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是CE(填字母代号).
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(3)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表格:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol•L-1 | 0.44 | 0.60 | 0.60 |
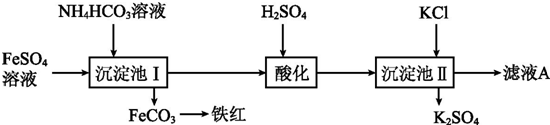
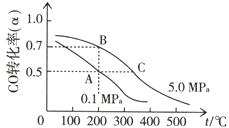 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.