题目内容
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式: .与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有 (填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为 .
(2)PO43-的空间构型是 .
(3)与NH3互为等电子体的分子、离子有 、 (各举一例).
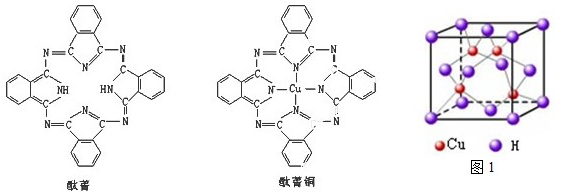
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为 .

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol CN-中含有的π键的数目为 .
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示.则该化合物的化学式为 .

(7)铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度 .
2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式:
(2)PO43-的空间构型是
(3)与NH3互为等电子体的分子、离子有
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol CN-中含有的π键的数目为
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示.则该化合物的化学式为

(7)铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,“等电子原理”的应用
专题:化学键与晶体结构
分析:(1)铜是29号元素,二价铜离子核外有27个电子,根据构造原理写出其核外电子排布式,铜最外层有1个电子,根据元素周期律比较电第一电离能;
(2)根据价层电子对互斥理论确定其空间构型;
(3)根据原子数和价电子数分别相等的两种微粒互为等电子体,可以写出等电子体的分子和离子;
(4)根据碳原子的成键情况要以判断碳原子的杂化方式;
(5)一个 CN-中含有2个π键;
(6)利用均摊法确定其化学式;
(7)根据ρ=
计算密度.
(2)根据价层电子对互斥理论确定其空间构型;
(3)根据原子数和价电子数分别相等的两种微粒互为等电子体,可以写出等电子体的分子和离子;
(4)根据碳原子的成键情况要以判断碳原子的杂化方式;
(5)一个 CN-中含有2个π键;
(6)利用均摊法确定其化学式;
(7)根据ρ=
| m |
| V |
解答:
解:(1)铜是29号元素,二价铜离子核外有27个电子,根据构造原理知,其核外电子排布式为:[Ar]3d9,铜最外层有1个电子,在同一周期中最外层一个电子的还有K、Cr,同一周期中,元素的第一电离能随着原子序数的增大而增大,但第VA族元素的第一电离能大于其相邻元素,所以N、O元素第一电离能为O<N,
故答案为:[Ar]3d9;K、Cr; O<N;
(2)PO43-中P原子的价层电子对=4+
(5+3-4×2)=4,且不含孤电子对,所以其空间构型正四面体,故答案为:正四面体;
(3)根据原子数和价电子数分别相等的两种微粒互为等电子体,可以写出等电子体的分子和离子分别为:PH3 或AsH3、H3O+或CH3-,故答案为:PH3 或AsH3、H3O+或CH3-;
(4)氨基乙酸铜的分子中一种碳有碳氧双键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化,故答案为:sp3、sp2;
(5)一个 CN-中含有2个π键,所以1mol CN-中含有的π键的数目为:2NA,故答案为:2NA;
(6)该晶胞中,铜原子个数=4+2×
+12×
=7,H原子个数=1+3+6×
=7,所以其化学式为CuH,故答案为:CuH;
(7)在铜晶胞中含有铜原子数为8×
+6×
=4,铜的原子半径为127.8pm,所以晶胞的边长为4×
×127.8pm,所以晶胞的密度为
g/cm3=9.0g/cm3,故答案为:9.0g/cm3.
故答案为:[Ar]3d9;K、Cr; O<N;
(2)PO43-中P原子的价层电子对=4+
| 1 |
| 2 |
(3)根据原子数和价电子数分别相等的两种微粒互为等电子体,可以写出等电子体的分子和离子分别为:PH3 或AsH3、H3O+或CH3-,故答案为:PH3 或AsH3、H3O+或CH3-;
(4)氨基乙酸铜的分子中一种碳有碳氧双键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化,故答案为:sp3、sp2;
(5)一个 CN-中含有2个π键,所以1mol CN-中含有的π键的数目为:2NA,故答案为:2NA;
(6)该晶胞中,铜原子个数=4+2×
| 1 |
| 2 |
| 1 |
| 6 |
| 1 |
| 3 |
(7)在铜晶胞中含有铜原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| 2 |
| ||||
(4×
|
点评:本题考查了物质结构及性质,这些知识点都是考查热点,难点是化学式的确定,注意该题中每个顶点上的原子被6个晶胞占有而不是8个晶胞占有,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一种新型绿色电池-燃料电池,是把H2、CO、CH4气体和空气不断输入直接氧化,使化学能转变为电能,它被称为21世纪的绿色发电站,这三种气体可以作为燃料电池所需燃料的理由是( )
| A、都是无毒无害气体 |
| B、在自然界都大量存在 |
| C、都可以燃烧并放出大量的热 |
| D、燃烧产物均为CO2和H2O |
 X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A、气态氢化物的稳定性:X>Y |
| B、Z元素的氧化物对应的水化物一定是一种强酸 |
| C、X、Y、Z原子半径的大小顺序:X>Y>Z |
| D、X的气态氢化物与W的气态氢化物可以相互反应 |
 如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线.
如图表示常温常压下N2(g)与H2(g)反应生成NH3(g)过程中的能量变化曲线,a和b表示不同条件下反应过程中的能量变化曲线. 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液480mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液480mL.根据这两种溶液的配制情况回答下列问题: