题目内容
19. 气态废弃物中的硫化氢可用下法转化为可利用的硫.
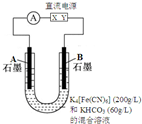
气态废弃物中的硫化氢可用下法转化为可利用的硫.(1)用如图所示电解池电解,观察到A电极有气泡逸出.
①混合溶液中KHCO3的物质的量浓度为0.6mol/L.
②取少量电解后B极溶液与绿矾溶液混合,观察到有蓝色沉淀产生,据此判断X是直流电源的负极(填“正”或“负”),产生蓝色沉淀的离子方程式为2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓.
③电解后A电极附近溶液的pH增大(填“增大”或“减小”),A电极的总反应式为2HCO3-+2 e-═H2↑+2CO32-.
(2)向电解后的溶液中,通入含H2S的气态废弃物,得到可以利用的硫,余下的电解质溶液可以循环利用.写出硫化氢转化为硫的总反应离子方程式2[Fe(CN)6]3-+2CO32-+H2S═2[Fe(CN)6]4-+2HCO3-+S↓.
分析 (1)①KHCO3的浓度为60g/L,可知1L溶液中含有60gKHCO3,物质的量为0.6mol;
②取少量电解后B极溶液与绿矾溶液混合,观察到有蓝色沉淀产生,说明B极含有Fe(CN)6]3-;
③A为阴极,阴极反应式为2HCO3-+2 e-═H2↑+2CO32-;
(2)电解后溶液中含有[Fe(CN)6]3-、CO32-,然后通入H2S生成硫.
解答 解:(1)①KHCO3的浓度为60g/L,可知1L溶液中含有60gKHCO3,物质的量为$\frac{60g}{100g/mol}$=0.6mol,则物质的量浓度为0.6mol/L,故答案为:0.6mol/L;
②A取少量电解后B极溶液与绿矾溶液混合,观察到有蓝色沉淀产生,说明B极含有Fe(CN)6]3-,阴离子向阳极移动,则X为负极,Y为正极,产生蓝色沉淀的离子方程式为2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓,
故答案为:负;2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓;
③A为阴极,阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,由于CO32-的水解程度大于HCO3-,所以碱性增强,则pH变大,
故答案为:增大;2HCO3-+2 e-═H2↑+2CO32-;
(2)电解后溶液中含有[Fe(CN)6]3-、CO32-,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO32-+H2S═2[Fe(CN)6]4-+2HCO3-+S↓,
故答案为:2[Fe(CN)6]3-+2CO32-+H2S═2[Fe(CN)6]4-+2HCO3-+S↓.
点评 本题考查氧化还原反应计算及电解等,综合性较强,注重氧化还原反应应用能力的考查,把握习题中的信息及迁移应用为解答的关键,题目难度中等.

| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA | |
| C. | 2 L 0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| D. | 1 mol Na2O2固体中含离子总数为4NA |
| A. | Na+、C1-、NO3-、H+ | B. | K+、Cl-、SO42-、H | ||
| C. | Fe3+、C1-、SO42-、NH4+ | D. | Ca2+、HCO3-、Cl-、NO3- |
①X+Ca(OH)2→Y+CaCO3↓
②W$\stackrel{△}{→}$X+CO2↑+H2O
③Z+CO2→X+O2
④Z+H2O→Y+O2↑
则X、Y、Z、W依次是( )
| A. | KCl、KOH、K2CO3、KHCO3 | B. | K2CO3、KOH、K2O2、KHCO3 | ||
| C. | K2SO3、KOH、K2O2、KHCO3 | D. | KHCO3、KOH、K2O2、K2CO3 |
| 选项 | 古文或谚语 | 化学解释 |
| A | 日照香炉生紫烟 | 碘的升华 |
| B | 以曾青涂铁,铁赤色如铜 | 置换反应 |
| C | 煮豆燃豆箕,豆在斧中泣 | 化学能转化为热能 |
| D | 雷雨肥庄稼 | 自然界固氮作用 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| B. | 电解法精炼粗铜,用粗铜作阳极,纯铜作阴极 | |
| C. | 电解熔融Al2O3制备金属铝时,加入冰晶石使Al2O3更易熔化 | |
| D. | 氯碱工业中电解食盐水时,阳离子交换膜可防止氯气与NaOH溶液反应 |
| A. | 海水晒盐 | B. | 煤的气化 | C. | 石油裂化 | D. | 氨溶于水 |
| A. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| B. | 利用重结晶可对粗苯甲酸进行提纯 | |
| C. | 不能用核磁共振氢谱来鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 |
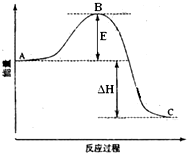 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: