题目内容
1.光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.(1)实验室中常用来制备氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO和H2,已知CH4、H2和CO的燃烧热(△H)分别为a kJ/mol、b kJ/mol和c kJ/mol,则生成1molCO时放出的热量为(0.5a-b-c)KJ;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为CHCl3+H2O2═COCl2+HCl+H2O;
(4)COCl2的分解反应为COCl2(g)═Cl2(g)+CO(g)△H=+108kJ/mol.反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线来示出):
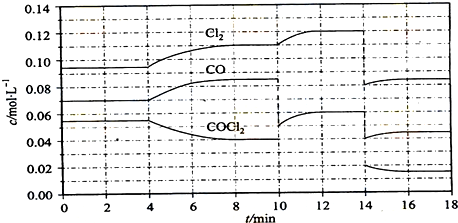
①计算反应在第8min时的平衡常数K=0.234KJ/mol
②比较第2min反应温度T(2)与第8min反应温度(T8)的高低:T(2)<T(8)(填“<”、“>”或“=”);
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=0.03mol/L;
④比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6)>v(15-16)(填“<”、“>”或“=”),原因是相同温度下,该反应的浓度减小,反应速率减慢.
分析 (1)实验室通常用二氧化锰与浓盐酸共热的方法制备氯气;
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式,利用盖斯定律书写该反应的热化学方程式,据此计算;
(3)CHCl3中碳为+2价,COCl2中碳为+4价,故H2O2中氧元素化合价由-1价降低为-2价,生成H2O,由电子转移守恒与原子守恒可知可知,CHCl3、H2O2、COCl2、H2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成;
(4)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,代入平衡常数表达式计算;
②第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动,4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,据此结合温度对平衡影响判断;
③由图可知,10min瞬间Cl2浓度不变,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl2);
④在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气与水制取氯气,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=akJ•mol-1;
②O2(g)+2H2(g)=2H2O(l)△H=2bkJ•mol -1;
③2CO(g)+O2(g)=2CO2(g)△H=2ckJ•mol-1,
利用盖斯定律将①-②-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=(a-2b-2c)kJ•mol-1,则生成1molCO时放出的热量为-$\frac{1}{2}$×(a-2b-2c)=(0.5a-b-c)KJ;
故答案为:(0.5a-b-c)KJ;
(3)CHCl3中碳为+2价,COCl2中碳为+4价,故H2O2中氧元素化合价由-1价降低为-2价,生成H2O,由电子转移守恒与原子守恒可知可知,CHCl3、H2O2、COCl2、H2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成,故反应方程式:CHCl3+H2O2═COCl2↑+HCl+H2O;
故答案为:CHCl3+H2O2═COCl2+HCl+H2O;
(4)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,故该温度下化学平衡常数K=$\frac{0.11mol/L×0.85mol/L}{0.04mol/L}$=0.234 KJ/mol;
故答案为:0.234 KJ/mol;
②第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动.4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,又因为正反应为吸热反应,所以T(2)<T(8);
故答案为:<;
③由图可知,10min瞬间Cl2浓度不变,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:$\frac{0.06mol/L×0.12mol/L}{c(COC{l}_{2})}$0.234mol/L,解得c(COCl2)=0.03mol/L;
故答案为:0.03;
④在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16);
故答案为:>;相同温度下,该反应的浓度减小,反应速率减慢.
点评 本题涉及化学方程式、热化学方程式的书写和化学平衡图象的有关计算,意在考查考生对反应热、化学平衡等化学反应原理掌握的情况,难度中等.

| A. | H2O2的溶液中:Na+,F-,SO32- | |
| B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| C. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:K+、Ba2+、Cl-、NO3- | |
| D. | pH=1的溶液中:Na+,K+,Cl-,S2O32- |
| A. | 次氯酸钙 | B. | 氢硫酸 | C. | 硫酸亚铁 | D. | 亚硫酸 |
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 该反应平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ | |
| C. | 溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变 | |
| D. | 达到平衡时c(Fe2+)=c(Cu2+) |
aA(g)+bB(g)?2C(g)
| 起始浓度(mol/L) | 1.5 | 1.0 | 0 |
| 2s末浓度(mol/L) | 0.9 | 0.8 | 0.4 |
(2)由碳棒、铁片和200mL 1.5mol•L-1的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求:①有1.806×1023个电子通过了电线(NA=6.02×1023 mol-1).
②此时溶液中H+的物质的量浓度为1.5mol•L-1 (不考虑溶液体积变化).
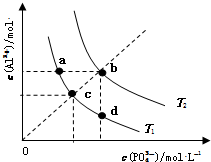
| A. | 图象中四个点的Ksp:a=b>c>d | B. | AlPO4在b点对应的溶解度大于c点 | ||
| C. | AlPO4(s)?Al3+(aq)+PO43-(aq)△H<0 | D. | 升高温度可使d点移动到b点 |
| A. | 纯净空气 | B. | 鸡蛋清水溶液 | C. | 牛奶 | D. | 淀粉溶液 |
| A. | 食盐水、糖水和冰水都是饮料,属于混合物 | |
| B. | O2不能导电,故O2是非电解质 | |
| C. | 烧碱属于碱,纯碱属于盐 | |
| D. | NaHSO4能电离出氢离子,故NaHSO4属于酸 |
