题目内容
16.根据所学知识填空:(1)已知某反应的各物质浓度数据如下:aA(g)+bB(g)?2C(g)
| 起始浓度(mol/L) | 1.5 | 1.0 | 0 |
| 2s末浓度(mol/L) | 0.9 | 0.8 | 0.4 |
(2)由碳棒、铁片和200mL 1.5mol•L-1的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求:①有1.806×1023个电子通过了电线(NA=6.02×1023 mol-1).
②此时溶液中H+的物质的量浓度为1.5mol•L-1 (不考虑溶液体积变化).
分析 (1)①根据浓度变化量之比等于化学计量数之比计算解答;②根据反应速率v=$\frac{△c}{△t}$计算;
(2)①氧化还原反应中电子转移数目即为电线中通过的电子,根据碳棒的反应2H++2e-=H2↑;
②根据生成的氢气计算出参加反应的H+的物质的量,计算出溶液中H+的物质的量浓度变化量,原稀硫酸溶液中H+的物质的量浓度减去溶液中H+的物质的量浓度变化量,即为所求溶液中H+的物质的量浓度.
解答 解:(1)aA(g)+bB(g)?2C(g)
起始浓度(mol/L) 1.5 1.0 0
变化浓度(mol/L) 0.6 0.2 0.4
2s末浓度(mol/L) 0.9 0.8 0.4
①浓度变化量之比等于化学计量数之比,则a:b:c=0.6:0.2:0.4=3:1:2,已知c为2,则a=3,b=1;
故答案为:3; 1
②2s内B的反应速率v=$\frac{0.2ml/L}{2s}$=0.1 mol•L-1•s-1;
故答案为:0.1 mol•L-1•s-1
(2)①碳棒上产生气体有$\frac{3.6L}{22.4L/mol}$=0.15mol,碳棒的反应为2H++2e-=H2↑;反应转移的电子的物质的量0.15mol×2=0.3mol,所以电线中通过的电子数目为0.3mol×6.02×1023mol-1=1.806×1023;
故答案为:1.806×1023
②原溶液为200mL 1.5mol•L-1的稀硫酸,H+:0.2L×1.5mol/L×2=0.6mol/L,由上问知反应H+反应了0.3mol,此时溶液中H+的物质的量为0.6mol-0.3mol=0.3mol,则H+的物质的量浓度为$\frac{0.3mol}{0.2L}$=1.5mol/L;
故答案为:1.5 mol•L-1
点评 本题考查化学平衡及反应速率计算、原电池、溶液计算等,综合较大,要求学生对基础知识熟练掌握并应用.

| A. | 实验室蒸馏石油时,将温度计的水银球插入液面下 | |
| B. | 稀释浓硫酸时,将浓硫酸沿玻璃棒慢慢注入盛有水的烧杯内并不断用玻璃棒搅拌 | |
| C. | 用蒸发皿蒸发液体时,未垫上石棉网直接加热蒸发皿 | |
| D. | 配制一定物质的量浓度的溶液时,清洗后未经干燥的容量瓶直接用于实验 |

| A. | 25℃时,NaHCO3在水中的溶解度比 Na2CO3的大 | |
| B. | 石灰乳与 Cl2 的反应中,Cl2 既是氧化剂,又是还原剂 | |
| C. | 常温下干燥的 Cl2 能用钢瓶贮运,所以 Cl2 不与铁反应 | |
| D. | 图示转化反应都是氧化还原反应 |
(1)已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111kJ•mol-1 2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1.请写出水蒸气通过红热的碳产生水煤气的热化学方程式C(s)+H2O(g)?CO(g)+H2(g)△H=+131kJ•mol-1.一定温度下,在一个容积固定的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是abce(填字母编号).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2) e.容器中混合气体的密度不再改变
(2)将不同物质的量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表中所示的三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mi n | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为吸(填“吸”或“放”)热反应.
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是b=2a,且a>1(用含a、b的代数式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应过程中能量的变化.

①在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使CH3OH的体积分数增大的是cde(填字母编号).
a.升高温度 b.充入He(g) c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
e.将该密闭容器改为恒压密闭容器
②容器中反应的逆反应速率随时间变化的关系如图2.t2时改变了某一种条件,改变的条件可能是升高温度.(任写一点)
 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.Ⅰ.已知反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃时的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
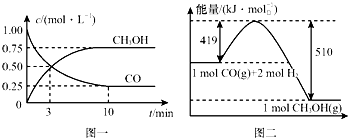
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)已知氢气的燃烧热为286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式:CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物 投入的量 | 反应物的 转化率 | CH3OH 的浓度 | 能量变化(Q1、 Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1 kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2 kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3 kJ热量 |
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.

| A. | 图象中四个点的Ksp:a=b>c>d | B. | AlPO4在b点对应的溶解度大于c点 | ||
| C. | AlPO4(s)→Al3+(aq)+PO43-(aq)△H<0 | D. | 升高温度可使d点移动到b点 |
| A. | 氯气的CCl4溶液不能使干燥红色布条褪色 | |
| B. | 通过化学变化可以实现16O与18O间的相互转化 | |
| C. | 为了便于运输和使用,可以将液氯储存在钢瓶(主要成分为铁)中 | |
| D. | 700℃时,4Na+CCl4=C+4NaCl,该反应属于置换反应 |

