题目内容
11.下列各组顺序的排列不正确的是( )| A. | 离子半径:Na+>Mg2+>Al3+>F- | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:SiO2>NaCl>I2>CO2 |
分析 A.具有相同电子层排布的离子,质子数越多,半径越小;
B.元素非金属性越强,氢化物越稳定;
C.非金属性越强,最高价氧化物对应的水化物酸性越强;
D.一般熔点:原子晶体>离子晶体>分子晶体.
解答 解:A.具有相同电子层排布的离子,质子数越多,半径越小,所以离子半径:F->Na+>Mg2+>Al3+,故A错误;
B.因非金属性Cl>S>P>As,所以热稳定性:HCl>H2S>PH3>AsH3,故B正确;
C.因非金属性P>C>Si,所以酸性强弱:H2SiO3<H2CO3<H3PO4,故C正确;
D.SiO2是原子晶体,NaCl是离子晶体,I2和CO2是分子晶体,I2的相对分子质量大于CO2,所熔点:SiO2>NaCl>I2>CO2,故D正确;
故选A.
点评 本题考查元素周期律的递变规律,题目难度不大,学习中注意把握元素周期律,注意元素的性质与元素对应单质、化合物的性质之间的关系.

练习册系列答案
相关题目
1.将铁片插入下列溶液中,看不到反应现象的是( )
| A. | 稀硫酸 | B. | 稀盐酸 | C. | 硫酸铜 | D. | 浓硝酸 |
2.下列反应后只可能生成一种有机物的是( )
| A. | CH3-CH=CH2与HCl加成 | B. |  在浓硫酸存在下,发生分子内脱水 在浓硫酸存在下,发生分子内脱水 | ||
| C. |  在铁粉存在下与液溴反应 在铁粉存在下与液溴反应 | D. |  在浓硫酸存在下,发生分子内脱水 在浓硫酸存在下,发生分子内脱水 |
6.下列说法正确的是( )
| A. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| B. | 根据Ksp(CaCO3)<Ksp(CaSO4),在生产中可用Na2CO3溶液处理锅炉水垢中的CaSO4,使之转化为疏松、易溶于酸的CaCO3 | |
| C. | 常温下,将醋酸稀溶液加水稀释,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| D. | 已知反应:3H2(g)+WO3(s)=W(s)+3H2O(g)只有在高温时才能自发进行,则它的△S<0 |
3.用VSEPR 理论判断:
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的形状 |
| NH4+ | 1 | sp3 | 三角锥形 |
| NCl3 | 0 | sp3 | 正四面体形 |
20.在5L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g).起始反应时NO和CO各为3mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1mol.下列有关反应速率的说法中,正确的是( )
| A. | 达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小 | |
| B. | 反应前5秒钟内,用CO表示的平均反应速率为0.04 mol•L-1•s-1 | |
| C. | 当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变 | |
| D. | 保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变 |
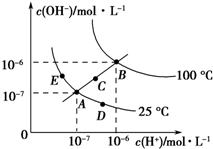 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题: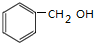
 ,该反应用于苯酚的定性检验和定量测定.
,该反应用于苯酚的定性检验和定量测定.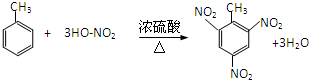 .
.