题目内容
已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“>”“=”).
(2)830℃时,向一个5L的密闭容器中充入0.20mol A和0.80mol B,如反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s时c(A)= mol?L-1,C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 .
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)830℃时,若向(2)平衡混合物中再充入0.10mo C和0.10mo D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B mol;达到新平衡时,A的物质的量为n(A)= .
(5)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为 .
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K=
(2)830℃时,向一个5L的密闭容器中充入0.20mol A和0.80mol B,如反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s时c(A)=
(3)判断该反应是否达到平衡的依据为
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)830℃时,若向(2)平衡混合物中再充入0.10mo C和0.10mo D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B
(5)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为
考点:化学平衡常数的含义,化学平衡状态的判断,化学平衡的计算
专题:化学平衡专题
分析:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,由表中数据可知,温度升高平衡常数降低,平衡向逆反应移动,故正反应为放热反应;
(2)根据△c=v△t计算△c(A),A的起始浓度-△c(A)=6s时c(A);
根据△n=△cV计算△n(A),再根据方程式计算C的物质的量;
设平衡时A的浓度变化量为x,利用三段式表示平衡时各组分的平衡浓度,代入平衡常数列方程计算x的值,再根据转化率定义计算;
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)各物质的物质的量分数与原平衡相同,说明与(2)是等效平衡,因为两这的计量数相等,所以用极端转化,相同物质成比例;
(5)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数.
(2)根据△c=v△t计算△c(A),A的起始浓度-△c(A)=6s时c(A);
根据△n=△cV计算△n(A),再根据方程式计算C的物质的量;
设平衡时A的浓度变化量为x,利用三段式表示平衡时各组分的平衡浓度,代入平衡常数列方程计算x的值,再根据转化率定义计算;
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)各物质的物质的量分数与原平衡相同,说明与(2)是等效平衡,因为两这的计量数相等,所以用极端转化,相同物质成比例;
(5)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数.
解答:
解:(1)可逆反应A(g)+B(g)?C(g)+D(g)的平衡常数k=
,由表中数据可知,温度升高平衡常数降低,平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:
;<;
(2)反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s内△c(A)=0.003mol?L-1?s-1×6s=0.018mol/L,A的起始浓度为
=0.04mol/L,故6s时时c(A)=0.04mol/L-0.018mol/L=0.022mol/L,故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变为80%,
设平衡时A的浓度变化量为x,则:
A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故
=1,解得x=0.032
所以平衡时A的转化率为
×100%=80%,
故答案为:0.022;0.09;80%;
(3)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误;
b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误;
c.可逆反应到达平衡时,各组分的浓度不发生变化,故c(A)不随时间改变,说明到达平衡,故c正确;
d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成C、D的物质的量,不能说明到达平衡,故d错误;
故答案为:c;
(4)在反应A(g)+B(g)?C(g)+D(g)中将转化为0.10mo C和0.10mo D,A、B各是0.10mol,设投B的量为xmol,由题意可知:
=
,则x=0.3mol,投A为0.02mol时平衡量为:0.04-0.032=0.008mol,则投AO为0.03mol时,A的平衡是物质的量为0.008×0.3÷0.2=0.012mol,
故答案为:0.3;0.012mol;
(5)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为
=2.5,
故答案为:2.5.
| c(C)?c(D) |
| c(A)?c(B) |
故答案为:
| c(C)?c(D) |
| c(A)?c(B) |
(2)反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s内△c(A)=0.003mol?L-1?s-1×6s=0.018mol/L,A的起始浓度为
| 0.2mol |
| 5L |
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变为80%,
设平衡时A的浓度变化量为x,则:
A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故
| x×x |
| (0.04-x)×(0.16-x) |
所以平衡时A的转化率为
| 0.032mol/L |
| 0.04mol/L |
故答案为:0.022;0.09;80%;
(3)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误;
b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误;
c.可逆反应到达平衡时,各组分的浓度不发生变化,故c(A)不随时间改变,说明到达平衡,故c正确;
d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成C、D的物质的量,不能说明到达平衡,故d错误;
故答案为:c;
(4)在反应A(g)+B(g)?C(g)+D(g)中将转化为0.10mo C和0.10mo D,A、B各是0.10mol,设投B的量为xmol,由题意可知:
| 0.1+0.2 |
| 0.8+x+0.1 |
| 0.2 |
| 0.8 |
故答案为:0.3;0.012mol;
(5)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为
| 1 |
| 0.4 |
故答案为:2.5.
点评:本题考查化学平衡计算、平衡常数计算、化学反应速率、平衡状态判断,难度中等,注意化学平衡状态判断,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
25℃时某溶液中,由水电离出的c(H+)和c(OH-)的乘积为1×10-26,下列有关说法中正确的是( )
| A、该溶液中的溶质不可能是NaHSO4 | ||
| B、向该溶液中加入铝粉,一定能产生大量H2 | ||
C、下列离子在该溶液中一定能大量共存:Ca2+、Cl-、K+、NO
| ||
| D、向该溶液中加入NaHCO3,一定有化学反应发生 |
下列图象描述正确的是( )
A、 可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应 可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应 |
B、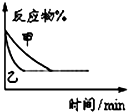 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 |
C、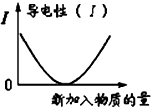 可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
D、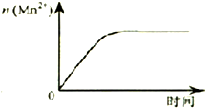 表示10mL 0.01 mol?L-1 KMnO4酸性溶液与过量的0.1mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 表示10mL 0.01 mol?L-1 KMnO4酸性溶液与过量的0.1mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式: (1)按系统命名法命名.有机物CH3CH(C2H5)CH(CH3)2的名称是
(1)按系统命名法命名.有机物CH3CH(C2H5)CH(CH3)2的名称是