题目内容
研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义.
(1)将煤转化为清洁气体燃料:
已知:H2(g)+
O2(g)=H2O(g)△H=-241.8kJ/mol
C(s)+
O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应制H2和CO的热化学方程式 .
(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g)?2SO3(g);
△H=-a kJ/mol,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mol SO2和2mol O2 B.4mol SO2、2mol O2和2mol SO3
C.4mol SO2和4mol O2 D.6mol SO2和4mol O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
A.压强不变 B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D.N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)△H>0,
简述该设想能否实现的依据 .
(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)?CO2(g)+H2(g).在420℃时,平衡常数K=9.若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为 .
(1)将煤转化为清洁气体燃料:
已知:H2(g)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
写出焦炭与水蒸气反应制H2和CO的热化学方程式
(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g)?2SO3(g);
△H=-a kJ/mol,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mol SO2和2mol O2 B.4mol SO2、2mol O2和2mol SO3
C.4mol SO2和4mol O2 D.6mol SO2和4mol O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
A.压强不变 B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D.N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)△H>0,
简述该设想能否实现的依据
(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)?CO2(g)+H2(g).在420℃时,平衡常数K=9.若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
考点:热化学方程式,反应热和焓变,化学平衡状态的判断,等效平衡,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题
分析:(1)利用盖斯定律,通过已知热化学方程式运算得目标热化学方程式;
(2)由反应方程式可知生成2mol的SO3时放热a kJ,想得到2a kJ热量,则需生成4molSO3;由于反应是可逆反应,不可能完全进行到底,所以要得到4molSO3,SO2与O2物质的量必须要多于4mol和2mol.
(3)①可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.
②根据G=△H-T?△S判断反应能否自发进行;
(4)依据化学平衡的三段式列式计算,平衡状态下的物质转化率=
×100%,运用平衡常数的概念列式得到.
(2)由反应方程式可知生成2mol的SO3时放热a kJ,想得到2a kJ热量,则需生成4molSO3;由于反应是可逆反应,不可能完全进行到底,所以要得到4molSO3,SO2与O2物质的量必须要多于4mol和2mol.
(3)①可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.
②根据G=△H-T?△S判断反应能否自发进行;
(4)依据化学平衡的三段式列式计算,平衡状态下的物质转化率=
| 消耗量 |
| 起始量 |
解答:
解:(1)①H2(g)+
O2(g)=H20 (g)△H=-241.8kJ?mol-1 ①
C(s)+
O2(g)=CO (g)△H=-110.5kJ?mol-1②
利用盖斯定律将方程式变形:②-①得 C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
(2)由反应方程式可知生成2mol的SO3时放热a kJ,想得到2a kJ热量,则需生成4molSO3;由于反应是可逆反应,不可能完全进行到底,所以要得到4molSO3,SO2与O2物质的量必须要多于4mol和 2mol,故D符合,B选项中既有正反应又有逆反应,最终放出的热量小于2akJ,
故选D;
(3)①A.反应是前后气体系数和不变化的反应,所以压强不变,反应不一定平衡,故A错误;
B.混合气体平均相对分子质量=
,m、n均不会变化,所以M不变,即M不变不一定平衡,故B错误;
C.2v正(N2)=v逆(NO)证明正逆反应速率相等,即达到了平衡,故C正确;
D.N2的体积分数不再随时间的改变改变,证明达到了平衡,故D正确.
故选CD;
②2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T?△S,G>0,不能实现,
故答案为:不能;该反应是熵减、焓增的反应,任何温度下均不能自发进行;
(4)解:依据化学平衡,设一氧化碳的消耗浓度为X,分析三段式列式计算:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 0.1 0.1 0 0
变化量(mol/L) X X X X
平衡量(mol/L) 0.1-X 0.1-X X X
平衡常数K=
=
=9
解得:X=0.075mol/L;
一氧化碳转化率=
×100%=75%,故答案为:75%.
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
利用盖斯定律将方程式变形:②-①得 C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
(2)由反应方程式可知生成2mol的SO3时放热a kJ,想得到2a kJ热量,则需生成4molSO3;由于反应是可逆反应,不可能完全进行到底,所以要得到4molSO3,SO2与O2物质的量必须要多于4mol和 2mol,故D符合,B选项中既有正反应又有逆反应,最终放出的热量小于2akJ,
故选D;
(3)①A.反应是前后气体系数和不变化的反应,所以压强不变,反应不一定平衡,故A错误;
B.混合气体平均相对分子质量=
| m |
| n |
C.2v正(N2)=v逆(NO)证明正逆反应速率相等,即达到了平衡,故C正确;
D.N2的体积分数不再随时间的改变改变,证明达到了平衡,故D正确.
故选CD;
②2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T?△S,G>0,不能实现,
故答案为:不能;该反应是熵减、焓增的反应,任何温度下均不能自发进行;
(4)解:依据化学平衡,设一氧化碳的消耗浓度为X,分析三段式列式计算:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 0.1 0.1 0 0
变化量(mol/L) X X X X
平衡量(mol/L) 0.1-X 0.1-X X X
平衡常数K=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| X2 |
| (0.1-X)2 |
解得:X=0.075mol/L;
一氧化碳转化率=
| 0.075 |
| 0.1 |
点评:本题考查了盖斯定律的应用、化学平衡的三段式计算,平衡常数、转化率的概念计算应用,注意平衡状态的判断是关键,题目较简单.

练习册系列答案
相关题目
下列叙述与盐类水解无关的是( )
| A、草木灰与磷肥混合使用会降低肥效 |
| B、使用明矾、氯化铁作净水剂 |
| C、碳酸钙加入水中导电性很弱 |
| D、用硫酸铝和小苏打溶液制泡沫灭火器 |
下列物质所属的类别正确的是( )
| A、Na2CO3--盐 |
| B、干冰--混合物 |
| C、氢氧化铁胶体--纯净物 |
| D、NaHCO3--酸 |
浓硫酸具有的性质是( )
| A、强的氧化性 | B、碱性 |
| C、还原性 | D、两性 |
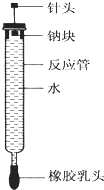 有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.
有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.