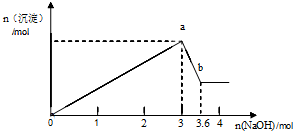
题目内容
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220.0kJ?mol-1
H2O(l)═H2O(g)△H=+44.0kJ?mol-1
则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为
(2)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2═2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将
考点:热化学方程式,有关反应热的计算,常见化学电源的种类及其工作原理
专题:化学反应中的能量变化,电化学专题
分析:(1)根据盖斯定律来计算化学反应的焓变,结合焓变和系数之间的关系来回答;
(2)根据盖斯定律来计算化学反应的焓变,书写热化学方程式即可;
(3)N4气体转变为N2气体先破坏N4分子N-N键吸收能量,再生成N2分子形成N≡N键放出能量,注意一个N4分子中含有6个N-N键,根据能量的变化写出热化学反应方程式;
(3)根据反应2H2+O2=2H2O可知,反应中氢气失电子被氧化,应在负极上的反应,氧气得电子被还原,应在正极上的反应,根据得失电子及反应类型写出相应的电极反应式;
(4)根据反应2H2+O2=2H2O可知,反应中氢气失电子被氧化,应在负极上的反应,氧气得电子被还原,应在正极上的反应,根据得失电子及反应类型写出相应的电极反应式.
(2)根据盖斯定律来计算化学反应的焓变,书写热化学方程式即可;
(3)N4气体转变为N2气体先破坏N4分子N-N键吸收能量,再生成N2分子形成N≡N键放出能量,注意一个N4分子中含有6个N-N键,根据能量的变化写出热化学反应方程式;
(3)根据反应2H2+O2=2H2O可知,反应中氢气失电子被氧化,应在负极上的反应,氧气得电子被还原,应在正极上的反应,根据得失电子及反应类型写出相应的电极反应式;
(4)根据反应2H2+O2=2H2O可知,反应中氢气失电子被氧化,应在负极上的反应,氧气得电子被还原,应在正极上的反应,根据得失电子及反应类型写出相应的电极反应式.
解答:
解:(1)①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220.0kJ?mol-1
②H2O(l)═H2O(g)△H=+44.0kJ?mol-1
则丙烷燃烧生成CO2和气态水时的反应为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g),△H=①+②×4=-2220.0kJ?mol-1+4×44.0kJ?mol-1=2044kJ?mol-1,所以
0.5mol丙烷燃烧生成CO2和气态水时释放的热量为1022kJ,故答案为:1022kJ;
(2)①TiO2 (s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
②2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ?mol-1;
故答案为:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ?mol-1;
(3)根据原子守恒知,一个N4分子生成2个N2分子,一个N4分子中含有6个N-N键,破坏1molN4分子中含有6molN-N键需要吸收193kJ/mol×6mol=1158KJ能量;
生成2molN≡N键放出941kJ/mol×2mol=1882KJ能量,所以该反应放出1884KJ-1158KJ=724KJ能量,所以热化学反应方程式为N4(g)=2N2(g)△H=-724KJ/mol,
故答案为:724;
(3)该电池属于原电池,是将化学能转变为电能的装置,该反应中氢气失电子被氧化,氢气失电子生成氢离子,所以电极反应式为2H2-4e-═4H+,氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以电极反应式为O2+4H++4e-═2H2O;
故答案为:化学;电;2H2-4e-═4H+;O2+4H++4e-═2H2O.
②H2O(l)═H2O(g)△H=+44.0kJ?mol-1
则丙烷燃烧生成CO2和气态水时的反应为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g),△H=①+②×4=-2220.0kJ?mol-1+4×44.0kJ?mol-1=2044kJ?mol-1,所以
0.5mol丙烷燃烧生成CO2和气态水时释放的热量为1022kJ,故答案为:1022kJ;
(2)①TiO2 (s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
②2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ?mol-1;
故答案为:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ?mol-1;
(3)根据原子守恒知,一个N4分子生成2个N2分子,一个N4分子中含有6个N-N键,破坏1molN4分子中含有6molN-N键需要吸收193kJ/mol×6mol=1158KJ能量;
生成2molN≡N键放出941kJ/mol×2mol=1882KJ能量,所以该反应放出1884KJ-1158KJ=724KJ能量,所以热化学反应方程式为N4(g)=2N2(g)△H=-724KJ/mol,
故答案为:724;
(3)该电池属于原电池,是将化学能转变为电能的装置,该反应中氢气失电子被氧化,氢气失电子生成氢离子,所以电极反应式为2H2-4e-═4H+,氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以电极反应式为O2+4H++4e-═2H2O;
故答案为:化学;电;2H2-4e-═4H+;O2+4H++4e-═2H2O.
点评:本题考查了盖斯定律及原电池原理,难点是电极反应式的书写,要根据电解质溶液的酸碱性书写,为易错点.

练习册系列答案
相关题目
下列有机反应的化学方程式和反应类型均正确的是( )
A、CH4+Cl2
| ||
B、nCH3-CH=CH2
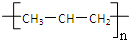 聚合反应 聚合反应 | ||
C、淀粉:(C6H10O5)n+nH2O
| ||
D、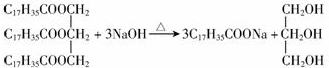 皂化反应 皂化反应 |
浓硫酸具有的性质是( )
| A、强的氧化性 | B、碱性 |
| C、还原性 | D、两性 |
在无色透明的酸性溶液中,能大量共存的离子组是( )
| A、Al3+、Na+、Cl-、SO42- |
| B、Cu2+、Ca2+、CO32-、Cl- |
| C、NH4+、Ba2+、NO3-、HCO3- |
| D、K+、Fe3+、Cl-、NO3- |
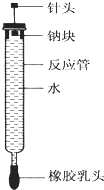 有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.
有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.