题目内容
20.下列化学用语或模型正确的是( )| A. | HCl的电子式: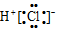 | B. | HClO的结构式:H-Cl-O | ||
| C. | NH4I的电子式: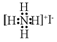 | D. | 甲烷分子球棍模型: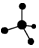 |
分析 A.HCl为共价化合物;
B.HClO含有-OH;
C.漏写I的最外层电子;
D.甲烷为正四面体结构.
解答 解:A.HCl为共价化合物,电子式为 ,故A错误;
,故A错误;
B.HClO含有-OH,结构式为H-O-Cl,故B错误;
C.没有标出碘离子的最外层电子,NH4I的电子式: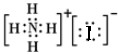 ,故C错误;
,故C错误;
D.甲烷为正四面体结构,甲烷分子中含有4个碳氢键,甲烷的球棍模型为 ,故D正确.
,故D正确.
故选D.
点评 本题考查了常见化学用语的表示方法,为高频考点,侧重考查双基,题目难度中等,注意掌握球棍模型与比例模型、结构简式、结构式及分子式的书写原则,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
11.“保护环境,就是保护自己.”目前,我国城市环境中主要的大气污染物是( )
| A. | SO2、NO、CO、烟尘 | B. | CO2、Cl2、N2、雾 | C. | HCl、NO2、N2、粉尘 | D. | CO2、NO、NH3、H2S |
8.设 NA 为阿伏加德罗常数的数值,下列说法错.误.的是( )
| A. | 一定条件下,2molSO2 和 1molO2 混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 256g S8 分子中含 S-S 键为 7NA 个 | |
| C. | 由 1molCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为 NA 个 | |
| D. | 1 mol Na 与 O2 完全反应,生成 NaO2 和 Na2O2的混合物,转移电子总数为 NA 个 |
12.短周期元素a、b、c、d原子序数依次增大.a的核外电子总数与其周期数相同,b的某种单质是空气的主要成分,c的最外层电子数为其内层电子数的3倍,d与c同族;下列说法错误的是( )
| A. | a、b、d均可以与c形成两种或多种二元化合物 | |
| B. | 阴离子的还原性d大于c | |
| C. | a与d形成的化合物可以抑制水的电离 | |
| D. | 常温下,由这四种元素构成的某种盐的溶液pH=4,则水电离出的H+浓度肯定是1×10-4mol/L |
9.二碳化学的研究在工业生产中具有重要意义.
(1)在一定温度和压强下,已知:
①CH3CH2OH(g)+$\frac{1}{2}$O2(g)?CH3CHO(g)+H2O(g)△H1=203kJ•mol-1.
②若2CH3CHO(g)+O2(g)?2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g)?CH3COOH(g)+H2O(g)△H2 <0(填“>”、“<”或“=”).
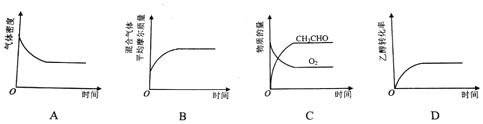
(2 )将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)?2CH3CHO(g)+2H2O(g)至平衡状态.下列图象不合理的是B.
(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3•H2O)=1.75×10-5,$\sqrt{1.75}$≈1.3,lgl.3≈0.1
①25℃,0.lmol•L-1CH3COOH 溶液的pH=2.9;将0.1mol•L-1CH3COOH溶液与0.1mol•L-1的氨水等体积混合,所得溶液中离子浓度大小关系为c(CH3COO-)=c(NH4+)>c(H+)=c(OH-).
②25℃,0.2mol•L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=5.7×10-10 (保留2位有效数字).
③25℃,向0.1mol•L-1氨水中加入少量NH4Cl固体,NH3•H2O?NH4++OH-的电离平衡逆(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3•H2O是弱电解质取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅.证明NH3•H2O是弱电解质;.
(1)在一定温度和压强下,已知:
| 化学键 | C-H | C-O | O-H | C=O | O=O | C-C |
| 键能(kJ•mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
②若2CH3CHO(g)+O2(g)?2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g)?CH3COOH(g)+H2O(g)△H2 <0(填“>”、“<”或“=”).
(2 )将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)?2CH3CHO(g)+2H2O(g)至平衡状态.下列图象不合理的是B.

(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3•H2O)=1.75×10-5,$\sqrt{1.75}$≈1.3,lgl.3≈0.1
①25℃,0.lmol•L-1CH3COOH 溶液的pH=2.9;将0.1mol•L-1CH3COOH溶液与0.1mol•L-1的氨水等体积混合,所得溶液中离子浓度大小关系为c(CH3COO-)=c(NH4+)>c(H+)=c(OH-).
②25℃,0.2mol•L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=5.7×10-10 (保留2位有效数字).
③25℃,向0.1mol•L-1氨水中加入少量NH4Cl固体,NH3•H2O?NH4++OH-的电离平衡逆(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3•H2O是弱电解质取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅.证明NH3•H2O是弱电解质;.


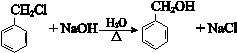 .
.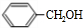 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2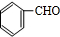 +2H2O.
+2H2O. .
.
 某种食品的配料标签如图所示:
某种食品的配料标签如图所示: