题目内容
将Cu放入0.1mol?L-1的FeCl3溶液中,反应一定时间后取出Cu,溶液中Fe2+、Fe3+的浓度比为3:2,则Cu2+和Fe3+的物质的量之比为( )
| A、3:2 | B、3:5 |
| C、4:3 | D、3:4 |
考点:离子方程式的有关计算
专题:计算题
分析:先利用假设法求出二价铁离子、三价铁离子的物质的量,再根据离子方程式中铜离子和二价铁离子的关系求出铜离子的物质的量.进而计算溶液中Cu2+和Fe3+的物质的量之比.
解答:
解:将Cu片放入FeCl3溶液中.发生反应:Cu+2Fe3+=Cu2++2Fe2+,假设溶液中n(Fe2+)=3mol,则溶液中n(Fe3+)=2mol,由离子方程式可知,n(Cu2+)=
n(Fe2+)=
×3mol=1.5mol,所以n(Cu2+):n(Fe3+)=1.5mol:2mol=3:4,
故选D.
| 1 |
| 2 |
| 1 |
| 2 |
故选D.
点评:本题考查的是铜的化学性质、离子方程式的有关计算,利用赋值法法简化计算步骤,侧重对学生分析思维能力的考查,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各图所示的装置中,肯定不符合防倒吸要求的是( )
A、 |
B、 |
C、 |
D、 |
pH=1的两种酸溶液X和Y分别与足量的锌反应,酸X比酸Y产生的氢气多,下列结论正确的是( )
| A、X是强酸,Y是弱酸 |
| B、X是弱酸,Y是强酸 |
| C、X是二元酸,Y是一元酸 |
| D、无法判断X、Y的上述性质 |
下列说法错误的是( )
| A、主族元素的原子核外电子最后填入的能级是s能级或p能级 |
| B、BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 |
| C、NH4+和CH4属于等电子体,立体构型都是正四面体 |
| D、向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的Cu(OH)2沉淀 |
下列微粒对CH3COO-+H2O?CH3COOH+OH-水解平衡有影响的是( )
| A、H2O |
B、 |
| C、NO3- |
| D、Ba2+ |
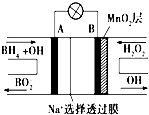 新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )| A、放电过程中,Na+从正极区向负极区迁移 |
| B、电极B材料中含MnO2层,MnO2可增强导电性 |
| C、电池负极区的电极反应:BH4-+8OH--8e-=BO2-+6H2O |
| D、电池反应中,每消耗1 L 6 mol/L H2O2溶液,理论上流过电路中的电子为6NA个 |
在烧杯中加水和苯(密度:0.88g?cm-3)各50ml,将以块金属钠(密度:0.97g?cm-3)投入杯中.观察到的现象可能是( )
| A、钠在水层中反应并四处游动 |
| B、钠停在苯层中不反应 |
| C、钠在苯的液面上反应并四处游动 |
| D、钠在苯与水的界面处反应并可能上下跳动 |
常温下,已知某溶液中水电离的c(H+)=10-12 mol/L,那么,该溶液中可能大量共存的离子是( )
| A、Na+、NH4+、Cl-、CH3COO- |
| B、K+、Fe2+、SO42-、NO3- |
| C、Na+、K+、CO32-、ClO- |
| D、Al3+、Cu2+、SO42-、HS- |