题目内容
11.工业上硫酸中的一步重要反应是SO2在400~5000C下的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应.如果在密闭容器中通入2molSO2和足够多的氧气,按上述条件进行反应,下列有关说法中错误的是( )| A. | 无论反应时间长短,最终生成的SO3一定少于2 mol | |
| B. | 使用催化剂的目的是加快反应速率,提高生产效率 | |
| C. | 达到平衡时,SO2和SO3的物质的量相等 | |
| D. | 该反应在较高温度下进行,有利于提高SO3的产率 |
分析 A、因该反应是可逆反应,存在反应限度,反应物不可能100%的转化;
B、使用催化剂加快了反应速率,缩短反应时间,提高反应效率;
C、达到平衡时,SO2的浓度与SO3的浓度可能相等,也可能不相等;
D、正反应是放热反应,升高温度平衡逆向移动.
解答 解:A、因该反应是可逆反应,存在反应限度,反应物不可能100%的转化,所以最终生成的SO3一定少于2 mol,故A正确;
B、使用催化剂加快了反应速率,缩短反应时间,提高反应效率,平衡不移动,故B正确;
C、达到平衡时,SO2的浓度与SO3的浓度可能相等,也可能不相等,要依据反应物的初始浓度及转化率,故C错误;
D、正反应是放热反应,升高温度平衡逆向移动,不利提高SO3的产率,故D错误;
故选CD.
点评 本题考查了影响化学平衡移动的因素,难度不大,注意影响化学反应速率和化学平衡的影响因素分析判断.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
2.废铅蓄电池的一种回收利用工艺流程如图所示: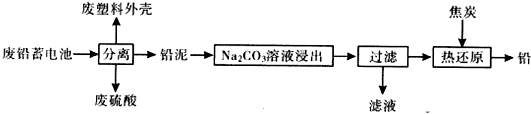
部分难溶电解质的性质如表:
回答下列问题:
(1)废铅蓄电池需回收处理的原因是金属资源的回收(或铅等重金属会引起污染、酸污染等)(回答一点)
(2)将废硫酸和滤液合并后可提取一种钠盐副产品(相对分子质量为322),已知副产品带10个结晶水的结晶水合物,则其化学式Na2SO4•10H2O,由滤液提取该副产品的主要实验步骤依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)利用铅泥中的PbSO4溶于CH3COONa溶液生成可溶于水的(CH3COO)2Pb,(CH3COO)2Pb溶液与KClO在强碱性条件下反应制取PbO2,写出后一步生成PbO2的离子方程式CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(4)25℃时,Na2CO3溶液浸出时发生反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq).测得滤液中c(CO32-)=1×10-5mol/L计算c(SO42-)=1.2mol/L
(5)滤渣PbCO3和焦炭共热可制得金属铅,写出该化学方程式2PbCO3+C$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+3CO2(或PbCO3+2C$\frac{\underline{\;\;△\;\;}}{\;}$Pb+3CO)
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.利用题目所给信息,设计实验区别PbCrO4和BaCrO4:取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.

部分难溶电解质的性质如表:
| 物质 | Ksp(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.4×10-20 | 白色 |
(1)废铅蓄电池需回收处理的原因是金属资源的回收(或铅等重金属会引起污染、酸污染等)(回答一点)
(2)将废硫酸和滤液合并后可提取一种钠盐副产品(相对分子质量为322),已知副产品带10个结晶水的结晶水合物,则其化学式Na2SO4•10H2O,由滤液提取该副产品的主要实验步骤依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)利用铅泥中的PbSO4溶于CH3COONa溶液生成可溶于水的(CH3COO)2Pb,(CH3COO)2Pb溶液与KClO在强碱性条件下反应制取PbO2,写出后一步生成PbO2的离子方程式CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(4)25℃时,Na2CO3溶液浸出时发生反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq).测得滤液中c(CO32-)=1×10-5mol/L计算c(SO42-)=1.2mol/L
(5)滤渣PbCO3和焦炭共热可制得金属铅,写出该化学方程式2PbCO3+C$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+3CO2(或PbCO3+2C$\frac{\underline{\;\;△\;\;}}{\;}$Pb+3CO)
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.利用题目所给信息,设计实验区别PbCrO4和BaCrO4:取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.
19.下列物质中能够导电而且是电解质的是( )
| A. | 熔融的氢氧化钠 | B. | 稀盐酸 | C. | 硝酸钾晶体 | D. | 熔化的铁 |
6.有关实验的说法中正确的是( )
| A. | 除去铁粉中的铜粉,加入足量浓硫酸加热反应后进行过滤 | |
| B. | 不用任何其他试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液 | |
| C. | 制备Fe(OH)3胶体时,通常是将Fe(OH)3固体溶于沸水中 | |
| D. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
16.从海水提取溴的过程中,吸收塔内溴蒸气和吸收剂SO2发生的化学反应为:Br2+SO2+2H2O=2HBr+H2SO4,下列说法正确的是( )
| A. | SO2在反应中被还原 | B. | Br2在反应中失去电子 | ||
| C. | Br2在反应中表现氧化性 | D. | 1mol氧化剂在反应中得到1mol电子 |
3.下列物质中,不能使高锰酸钾酸性溶液褪色的是( )
| A. | 乙炔 | B. | 甲苯 | C. | 苯 | D. | 乙烯 |
20.下列措施一定能使反应速率加快的是( )
| A. | 升高温度 | B. | 加入生成物 | ||
| C. | 缩小容器体积 | D. | 增加反应物的物质的量 |
