题目内容
1.如图电化学装置工作一段时间后,在B池的b极产生气体1.12L(标况下),已知B池中溶液体积为1L,请回答:
(1)B装置是电解池(“原电池”或“电解池”),a电极是阳极;
(2)A装置中通甲烷一边的电极反应式:CH3OH-6e-+H2O=CO2+6H+.
(3)请写出B池的总反应式:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑(化学方程式),B池电解后溶液的pH=13;(忽略氯气与氢氧化钠溶液的反应,且NaCl足量,反应前后溶液体积不变).
(4)该电化学装置工作过程中,消耗A池氧气的物质的量为0.025mol.
分析 (1)A装置中甲烷与氧气发生自发的氧化还原反应,是原电池,则B为电解池;
(2)A装置中,酸性条件下,负极上甲醇失电子和水反应生成二氧化碳和氢离子;
(3)惰性电极电解NaCl溶液,生成NaOH、氢气、氯气;B池中b为阴极,阴极上生成氢气,a为阳极,阳极上生成氯气,根据电解方程式计算;
(4)根据电极方程式和电子守恒计算.
解答 解:(1)A装置中甲烷与氧气发生自发的氧化还原反应,是原电池,B有外加电源为电解池;故答案为:电解池;
(2)A装置中,酸性条件下,负极上甲醇失电子和水反应生成二氧化碳和氢离子,其电极方程式为:CH3OH-6e-+H2O=CO2+6H+;
故答案为:CH3OH-6e-+H2O=CO2+6H+;
(3)氯化钠和水在电解条件下生成氢气、氯气和氢氧化钠,所以电池反应式为2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
B池中b为阴极,阴极上生成氢气,a为阳极,阳极上生成氯气,已知n(H2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,则n(NaOH)=0.1mol,所以c(OH-)=$\frac{0.1mol}{1L}$=0.1mol/L,则溶液的pH=13;
故答案为:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;13;
(4)B池中电解生成氢气的物质的量为0.05mol,则转移电子为0.1mol,A池中正极的电极方程式为O2+4H++4e-═2H2O,转移0.1mol电子时,消耗氧气为0.025mol;
故答案为:0.025.
点评 本题考查原电池和电解池原理,侧重考查学生分析计算能力,明确各个电极上发生的反应是解本题关键,注意结合转移电子守恒进行计算,题目难度中等.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案| A. | 当正反应与逆反应速率相等时,平衡不移动 | |
| B. | 当正反应大于逆反应速率时,平衡向正反应方向移动 | |
| C. | 当正反应小于逆反应速率时,平衡向正反应方向移动 | |
| D. | 反应速率发生改变,平衡不一定发生移动 |
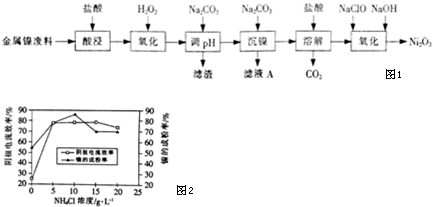
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3-、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
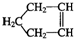
(5)工业上用镍为阳极,电解0.05-0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示.
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
| A. |  二乙酸乙二酯 二乙酸乙二酯 | B. |  2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | C. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |
| A. | 无论反应时间长短,最终生成的SO3一定少于2 mol | |
| B. | 使用催化剂的目的是加快反应速率,提高生产效率 | |
| C. | 达到平衡时,SO2和SO3的物质的量相等 | |
| D. | 该反应在较高温度下进行,有利于提高SO3的产率 |
 可简写为
可简写为 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为:
 ;
;
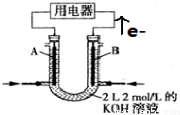 将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)
将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)