题目内容
16.从海水提取溴的过程中,吸收塔内溴蒸气和吸收剂SO2发生的化学反应为:Br2+SO2+2H2O=2HBr+H2SO4,下列说法正确的是( )| A. | SO2在反应中被还原 | B. | Br2在反应中失去电子 | ||
| C. | Br2在反应中表现氧化性 | D. | 1mol氧化剂在反应中得到1mol电子 |
分析 在反应Br2+SO2+2H2O═2HBr+H2SO4中,Br元素的化合价降低、S元素的化合价升高,以此来分析氧化还原反应.
解答 解:A、因S元素的化合价+4价升高+6价,则SO2为还原剂,在反应中被氧化,故A错误;
B、Br2为氧化剂,在反应得到电子,故B错误;
C、因Br元素的化合价由0降低为-1价,则Br2为氧化剂,在反应中表现氧化性,故C正确;
D、Br2为氧化剂,1mol氧化剂在反应中得到电子为1mol×2×(1-0)=2mol,故D错误;
故选C.
点评 本题考查氧化还原反应,明确元素的化合价及氧化还原反应中的基本概念即可解答,难度不大.

练习册系列答案
相关题目
6.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2,继而生产Ni2O3的工艺流程如图1下:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末等)等.
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3-、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05-0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示.
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
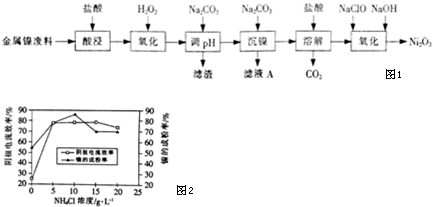
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3-、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05-0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示.
①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).

7.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 1 mol Cl2溶于水的过程中有1NA个电子转移 | |
| B. | 100℃时,1L pH=1的硫酸溶液中,含有0.1NA个H+ | |
| C. | 常温常压下,15g HCHO含有1.5NA对共用电子对 | |
| D. | 0.1mol•L-1的醋酸溶液中CH3COO-少于0.1NA个 |
4.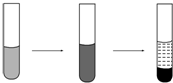 某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )
某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )
 某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )
某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )| A. | 一定有Fe2+,一定没有Fe3+、Mg2+ | |
| B. | 一定有Fe3+,一定没有Fe2+、Mg2+ | |
| C. | 一定有Fe3+,可能有Fe2+,一定没有Mg2+ | |
| D. | 一定有Fe2+,可能有Mg2+,一定没有Fe3+ |
11.工业上硫酸中的一步重要反应是SO2在400~5000C下的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应.如果在密闭容器中通入2molSO2和足够多的氧气,按上述条件进行反应,下列有关说法中错误的是( )
| A. | 无论反应时间长短,最终生成的SO3一定少于2 mol | |
| B. | 使用催化剂的目的是加快反应速率,提高生产效率 | |
| C. | 达到平衡时,SO2和SO3的物质的量相等 | |
| D. | 该反应在较高温度下进行,有利于提高SO3的产率 |
1.下列物质属于醇类的是( )
| A. | 乙醇 | B. | 苯酚 | C. | 乙酸 | D. | 乙醛 |
8.下列属于电解质的是( )
| A. | 铜 | B. | 硝酸钾溶液 | C. | 氢氧化钠 | D. | 蔗糖 |
5.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.5g甲基(-CH3)所含电子数目为NA | |
| B. | 标准状况下,11.2L苯中含有1.5NA 个碳碳双键 | |
| C. | 常温常压下,14 g乙烯和丙烯(C3H6)的混合气体中所含原子总数为3NA | |
| D. | 4.6 g Na与100 mL1.0 mol/L醋酸溶液反应,转移电子数目为0.1NA |
6.某离子反应中共有H20、H2C2O4、ClO3-、H+、CO2、ClO2六种微粒参与,已知在反应过程中溶液的pH逐渐增大.下列判断正确的是( )
| A. | 反应中CO2是还原产物 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 1mol H2C2O4参加反应转移4mol电子 | |
| D. | 当反应中有1mol电子转移时,有67.5g ClO2生成 |