题目内容
14.常温下,下列四种溶液:①0.10mol•L-1(NH4)2SO4②0.10mol•L-1NH3•H2O③0.10mol•L-1CH3COONH4④0.10mol•L-1NH4HSO4请根据要求填空:
(1)溶液①酸性,其原因是(用离子方程式表示):酸性,NH4++H2O?NH3•H2O+H+
(2)若将溶液②稀释10倍,则稀释后的溶液中c(OH-)大于原来的十分之一(填“大于”、“小于”或“等于”).
(3)实验测得溶液③的pH=7,则c(CH3COO-)=c(NH4+)(填“>”、“<”或“=”)
(4)上述四种溶液中,pH最小的是(填序号)④.
(5)上述四种溶液中,c(NH4+)由大到小的顺序为(填序号)①④③②.
分析 (1)铵盐硫酸铵中铵根离子水解导致溶液显示酸性;
(2)加水稀释会促进弱电解质的电离;
(3)根据溶液中的电荷守恒:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+)来回答;
(4)四种溶液中,pH最小,即酸性最强,氢离子浓度最大;
(5)根据电离出铵根离子的数目以及其他离子对铵根离子水解的影响知识来回答;
解答 解:(1)铵盐硫酸铵中,由于铵根离子水解而导致溶液显示酸性,即NH4++H2O?NH3•H2O+H+,故答案为:酸性;NH4++H2O?NH3•H2O+H+;
(2)加水稀释会促进弱电解质 NH3•H2O的电离,所以平衡正向进行会使得氢氧根离子浓度再增加,故答案为:大于;
(3)溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),显示中性时,c(OH-)=c(H+),所以c(CH3COO-)=c(NH4+),故答案为:=;
(4)四种溶液中,pH最小,即酸性最强,氢离子浓度最大,硫酸氢铵中氢离子能直接完全电离出来,所以氢离子浓度最大,故答案为:④;
(5)电离出铵根离子的数目①最多,②最少,硫酸氢铵中,氢离子对铵根离子的水解起到抑制作用,所以铵根离子浓度④>③,c(NH4+)由大到小的顺序是①④③②,故答案为:①④③②;
点评 本题涉及弱电解质的电离平衡的移动、盐的水解原理以及应用、溶液中的电荷守恒等方面的知识,综合性强,题目难度中等.

练习册系列答案
相关题目
12.下列变化属于物理变化的是( )
| A. | 煤的干馏 | B. | 钢铁生锈 | C. | 石油分馏 | D. | 粮食酿酒 |
5.N2与O2的混合气体的密度对氢气的相对密度为14.5,则N2在混合气体中的质量分数为( )
| A. | 72.4% | B. | 75% | C. | 50% | D. | 80.5% |
2.下列物质不能作为食品添加剂的是( )
| A. | 食盐 | B. | 蔗糖 | C. | 香料 | D. | 福尔马林 |
9.关于硝酸的说法不正确的是( )
| A. | 硝酸与金属反应时,主要是+5价的氮得电子 | |
| B. | 浓HNO3见光易分解,所以应保存在棕色试剂瓶中 | |
| C. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| D. | 常温下,向浓⑤中投入Fe片,无明显现象 |
19.下列反应的离子方程式正确的是( )
| A. | 过氧化钠投入水中:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 烧碱溶液吸收氯气:Cl2+2OH═Cl-+ClO-+H2O | |
| C. | 碳酸钙溶于盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 向氯化亚铁溶液中滴入氯水:Fe2++Cl2═Fe3++2Cl- |
3.下述实验操作与预期实验目的或所得实验结论不一致的是( )
| 编号 | 实验操作 | 实验目的或结论 |
| A | 将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 | 证明SO2有漂白性 |
| B | 向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 | 探究增大反应物浓度时平衡移动的方向 |
| C | 将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置于热水中,观察颜色变化 | 探究温度对化学平衡的影响 |
| D | 向硫酸铝溶液中滴加过量的氢氧化钡溶液 产生白色沉淀 | 证明氢氧化铝不溶于过量的氢氧化钡溶液 |
| A. | A | B. | B | C. | C | D. | D |
4.在卤代烃R-CH2-CH2-X中化学键如图所示,则下列说法正确的是( )
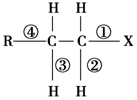

| A. | 发生水解反应时,被破坏的键是④ | |
| B. | 发生消去反应时,被破坏的键是①和② | |
| C. | 发生水解反应时,被破坏的键是①和④ | |
| D. | 发生消去反应时,被破坏的键是①和③ |
 为探究乙烯与溴的加成反应,甲乙两名同学进行如图实验设计:
为探究乙烯与溴的加成反应,甲乙两名同学进行如图实验设计: